近两年PD-1在癌症治疗领域如火如荼地兴起,到目前为止,已经有4款国产PD-1降价进入医保。在让更多患者享受到PD-1实惠的同时,开发领域也在不断升级免疫治疗的实力。目前已经有多家药企将目光投向双抗领域,除主体PD-1/PD-L1靶点外,还增加了另一个靶点药物提升疗效,形成一药双靶的升级免疫疗效。
2022年10月20日,国家药品监督管理局药品审评中心(CDE)网站公示,由康方生物完全独立自主研发的全球首创双特异性抗体新药依沃西(PD-1/VEGF双抗,AK112),拟被纳入突破性治疗品种名单,用于联合化疗治疗经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗耐药的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(nsq-NSCLC)。

什么是“双抗”
我们熟悉的PD-1抑制剂一般都是“XX单抗”,当单克隆抗体结合PD-1,会使癌细胞暴露在免疫细胞下,这样我们自身的免疫系统就会主动“杀死”癌细胞了。但是我们人体系统太复杂,仅靠”单抗“支撑有些势单力薄,况且当患者PD-L1表达较少,那么PD-1抑制剂的疗效似乎就不太理想了。这时候“双抗”就登场了,从原来的单脚跳变成了双脚行走。它具有两种特异性抗原结合位点,可以同时针对两种靶点。免疫检查点型仍然免疫检查点以 PD-1/PD-L1 作为一个靶点,但另一个靶点则选择抗血管生成、抗肿瘤生长、调节肿瘤微环境等目标,或者干脆再找另一个免疫检查点。
关于依沃西(PD-1/VEGF 双抗,AK112)
AK112是康方生物自主研发,全球行业内首个进入III期临床研究的PD-1/VEGF双特异性抗体。AK112 利用免疫协同抗血管生成策略,利用抗PD-1激活自身免疫攻击癌细胞的同时,协同抗 VEGF 阻断 VEGF 的免疫抑制和刺激肿瘤血管生成作用并促进 T 细胞在肿瘤组织中的浸润,从而提高疗效。

早在今年8月31日,AK112一线治疗 PD-L1 表达阳性(TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)已经被CDE纳入突破性治疗程序。

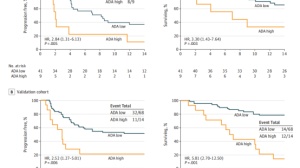
在2022 ASCO会议披露的Ⅱ期临床数据结果,AK112治疗1/2线NSCLC的ORR达到42.9%,DCR达到92.9%,在PD-L1阳性亚组中,ORR达到56.3%,DCR达到100%。

除此之外还有其他双抗也取得了优异的成绩:
康方生物的PD-1/CTLA-4双抗AK104
2022年6月29日,国家药监局(NMPA)附条件批准康方生物自主研发的PD-1/CTLA-4双特异性抗体药物开坦尼(卡度尼利单抗注射液)上市,用于治疗复发或转移性宫颈癌(R/M CC)。这是国内获批上市的首款双抗药物,也是全球获批的首款PD-1/CTLA-4双抗。
康宁杰瑞的PD-1/CTLA-4双抗KN046
2020年9月3日,获美国FDA授予孤儿药资格,用于治疗胸腺上皮肿瘤。
2020年12月23日,康宁杰瑞宣布,公司自主研发的抗HER2双特异性抗体KN026与PD-L1/CTLA-4双特异性单域抗体KN046联合疗法获美国FDA授予孤儿药资格,用于治疗HER2阳性或HER2低表达胃癌及胃食管连接部癌(GC/GEJ)。
今年,CDE官网公示,康宁杰瑞重组人源化PD-L1/CTLA-4双特异性单域抗体Fc融合蛋白注射液(KN046)获批临床,拟联合MAX-40279-01治疗晚期/转移性实体瘤。其中,MAX-40279-01为再极医药自研的1类新药。
信达生物和礼来共同研发的PD-1/PD-L1双抗IBI318
IBI318是由信达生物和礼来制药集团共同研发的PD-1/PD-L1双抗,在去年的ASCO年会上,信达生物制药公布了IBI318在治疗晚期恶性肿瘤的1a期临床试验中的表现。结果显示,IBI318有很好的耐受性,0.3mg到300mg的治疗组没有发现剂量限制性毒性(DLT)。其中11个患者出现发热和输液相关的反应(20.0%, G1/2),在300mg治疗组有一个患者出现免疫相关性不良事件(G2关节炎)。在9个接受≥10mg用药量患者中,有3个患者具有部分响应。
2018年6月初,默克在ASCO上公布了M7824用于非小细胞肺癌的临床实验数据,结果令人振奋。500mg 剂量治疗组PD-L1阳性患者(PD-L1不小于1%)ORR为22.6%,PD-L1高表达患者ORR为33.3%;1200mg剂量治疗组PD-L1阳性患者(PD-L1不小于1%)ORR达到了40.7%,PD-L1高表达患者中,ORR高达71.4%。这一表现显著优于PD-1抗体在同类患者中的治疗表现。
2018年12月,FDA授予M7824治疗胆管癌的孤儿药资格认定,获批基于同年10月ESMO大会上公布的M7824治疗胆管癌的最初数据:在接受铂类一线治疗后病情依然发展的亚洲患者中的临床活性。通过IRC评估,全部30名患者的客观缓解率(ORR)为20%,并且在PD-L1水平上观察到对治疗的响应,响应持续时间为8.3个月至13.9个月以上。2019年更新的数据显示30名患者的ORR为23%,中位PFS为2.6个月,中位OS为12.7个月。但是M7824单药治疗一线化疗失败或不耐受的晚期或转移性BTC患者的II期试验,结果显示,在超过9个月的随访后,独立审查委员会(IRC)根据RECIST v1.1标准判定客观缓解率为10.1% (95%CI, 5.9%-15.8%)。尽管有明显的获益,但该试验没有达到预先设定的阈值。虽然如此,但考虑到PD-L1单药免疫治疗BTC的ORR为5.8%左右,M7824作为二线治疗的单药临床活性仍然让人鼓舞。
关于奥希替尼耐药
自奥希替尼在国内上市以来,成为了许多肺癌晚期EGFR阳性患者的救命稻草。不仅延长了患者的生存时间,还提高了生存质量。作为三代EGFR靶向药,奥希替尼在患者群中的使用量逐渐增多,但数量的激增就意味着难逃耐药的宿命。针对三代EGFR抑制剂耐药后的治疗方案,成为医学界的热门话题。
面对奥希替尼耐药的问题,还可以查看往期文章,获取更多耐药后策略。
END
默克PDL1/TGF-β双抗M7824
本文仅供医学药学专业人士阅读













 X
X