众所周知,免疫细胞就像体内的警察,当人体出现肿瘤细胞时,抗肿瘤淋巴细胞就会被激活,去识别和杀灭这些肿瘤细胞,这就是免疫监视。
但是,在肿瘤细胞的微环境中,免疫抑制分子,像细胞毒性T淋巴细胞相关抗原(CTLA-4)、程序性细胞死亡蛋白和其受体(PD-1/PD-L1)常常是过表达的[1],使得肿瘤可以逃脱机体的免疫监视。针对这种现象,抗CTLA-4单克隆抗体(ipilimumab)和抗PD-1单克隆抗体(nivolumab/pembrolizumab)的相继出现,为肿瘤的治疗提供了全新的方法[2,3]。
但是,这些免疫抑制因子对自身免疫反应也起着重要的作用,一旦他们被抑制,一方面却是可以在一定程度上强化肿瘤特异性淋巴细胞对肿瘤组织的攻击和清除,但是另一方面也在一定程度上解除了免疫系统对自身正常组织的耐受,出现一系列免疫相关的不良事件(Immune-related adverse events,IRAEs)。当然,人们也一直在找寻方法避免这些不良反应的发生,比如使用类固醇激素进行抑制,但是这种方法也会抑制肿瘤特异性淋巴细胞对肿瘤组织的攻击,从而降低了药物的疗效[4]。因此,对免疫相关的不良事件的进一步深入研究就显得尤为重要。
目前,我们已知的与细胞毒性T淋巴细胞相关抗原(CTLA-4)有关的自身免疫耐受和针对其治疗所引起的自身免疫病主要包括了Graves病[5]、桥本病[6]、糖尿病[7]、脂泻病[8]、重症肌无力[9]、系统性红斑狼疮[10]、类风湿性关节炎和艾迪生氏病[5]等等。而与程序性细胞死亡蛋白和其受体(PD-1/PD-L1)治疗相关的自身免疫病则有系统性红斑狼疮[10]、类风湿性关节炎[11]和肾上腺功能不全[12]等。
各个器官都有可能因使用抗CTLA-4和/或抗PD-1/PD-L1而出现自身免疫性疾病,常见的自身免疫病见表1。

表1 抗CTLA-4和/或抗PD-1/PD-L1治疗引起的常见自身免疫疾病[13]
下面,我们就几种常见的自身免疫不良反应向大家做以简单介绍:
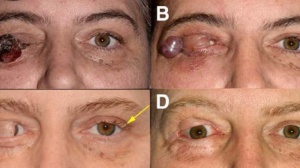
1:皮疹
Ribas A等人曾对39名使用抗CTLA-4药物的恶性肿瘤病人(34名黑色素瘤,4名肾细胞癌,1名结肠癌)进行过免疫副作用的研究,发现在使用抗CTLA-4药物后,皮炎往往是最为常见的免疫副作用,典型的皮炎经常在用药2周内出现,且至少持续1个月,主要表现为瘙痒性的红色斑丘疹,如图1[14]。在皮疹的治疗上,对于不良反应分级为1、2级的,常用止痒剂和类固醇激素进行局部涂抹,但是在使用类固醇激素涂抹前,我们必须确保皮肤并没有发生感染。而对于3、4级的不良反应,首先要做的是进行皮肤组织活检,已确定皮肤损伤的等级,系统性的使用类固醇激素也是一种比较合适的方法[13]。

图1 自身免疫反应引起的皮疹[14]
2:结肠炎
Beck KE等人对198名使用易普力姆玛的肿瘤患者进行了研究(包括肾细胞癌和黑色素瘤),发现免疫性结肠炎的表现与克罗恩病有很多类似的地方,在肠镜下都能观察到粘膜出现溃疡和红疹,肠隐窝内会出现淋巴细胞和中性粒细胞炎症,在部分病例中还会出现隐窝浓重和肉芽肿,如图2[15]。在出现肠炎症状时,区分肠炎的原因十分重要,必须排除由感染引起的肠炎,粪便的病原体检查就是一种重要的方法,而腹部的CT检查也能帮助明确肠炎的严重程度和具体范围[13]。对于级别仅为1、2级的自身免疫性肠炎,可使用布地奈德进行治疗,对于比较严重的肠炎,系统性全身性的类固醇治疗就是必须的了。而某些病例有时会出现激素治疗耐受的肠炎症状,此时可能需要短期使用抗肿瘤坏死因子α抗体英夫利昔[16]。

图2 肠隐窝破坏办中性粒细胞浸润[15]
3:甲状腺功能紊乱
Topalian SL等人在对296名使用抗PD-1治疗的病人进行了研究,发现在出现甲状腺功能紊乱的患者中,功能减退的患者要明显多于功能亢进的患者[17]。因为游离T3、T4的减少,患者会出现促甲状腺激素(TSH)的增高。在有些病人身上,有时会出现甲状腺功能亢进的现象,此时可使用非选择性β受体阻滞剂,像普萘洛尔,用以控制症状[13]。Orlov S等人的研究发现,在大多数的案例中,甲状腺功能亢进常能自然缓解,且最终会转变为甲状腺功能减退[18]。
4:自身免疫性肝炎
在Robert C等人的研究中,他们发现低于5%的病人会出现血清丙氨酸氨基转移酶(ALT)或是天冬氨酸氨基转移酶(AST)水平的升高,所以对于医生来说,如果病人在治疗后出现这些症状,就有可能是出现了自身免疫性肝炎,需要进一步关注[3]。病人常没有明显的特异性症状,仅仅表现为实验室检查的异常。在诊断自身免疫性肝炎时,各类病毒性肝炎需要首先被排除,而CT和B超也可以用来排除肝上的转移性肿瘤[13]。Kim KW等人的研究也发现,部分自身免疫性肝炎的患者会出现肝脏的重大、门静脉周围的水肿和淋巴结肿大[18]。当然,确诊自身免疫性肝炎需要对肝组织进行组织活检。在治疗方面,对于一般的自身免疫性肝炎患者,使用类固醇激素是必须的,对于激素治疗耐受的患者,Johnson PJ等人的研究发现可以同时使用咪唑硫嘌呤或MMF[20]。
5:免疫相关性肺炎
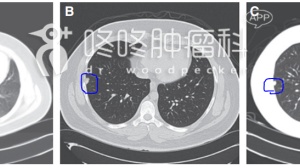
Topalian SL等人的研究发现,大约有1%左右的病人会出现免疫相关性肺炎[17]。此类肺炎常常会严重到危及生命,所以需要对病人的呼吸情况加以关注。其常见的症状为干咳和进行性的短促呼吸。CT检查和肺功能检测是常用的辅助诊断方法。Nishino M等人对3名因使用抗PD-1单抗而发生免疫性间质性肺炎的患者进行了研究,发现CT上常表现为肺部组织的网格状毛玻璃样改变,且会随着用药时间的延长而不断加重,如图3[21]。在下免疫相关性肺炎的诊断之前,左心功能不全和肺部感染性疾病需要首先排除[13]。在治疗方面,免疫相关性肺炎也是首选系统性的激素治疗[22],对于部分激素治疗效果不好的病人,也可同时联用免疫抑制剂,如英夫利昔[21]。

图3 A、B为同一免疫相关性肺炎病人使用抗PD-1单抗治疗22周和治疗24周时的CT影像,随着治疗时间的延长,肺部损伤逐渐加重。C、D为两名肺炎病人的CT影像,肺部均有网格状的毛玻璃样损伤。[21]
虽然抗CTLA-4单克隆抗体和抗PD-1单克隆抗体可能给病人多个器官系统带来自身免疫性损伤,但是此类抗肿瘤新药确实为人类战胜肿瘤提供了重要的武器,许多病人正是被此类新药所挽救,而我们接下来要做的就是不断提高药物抗肿瘤的特异性,不断减少其对自身免疫系统的干扰。而更加精准的抗肿瘤治疗也将是未来研究的一大方向。举个例子,如果我们能拥有更加精确的药物投送系统(DDS),能将抗肿瘤药物(如抗CTLA-4单克隆抗体和抗PD-1单克隆抗体)直接投送到肿瘤微环境中,而不是直接全身注射,其副作用将得到很好的控制,而这也是未来药品发展的一个重要方向。
参考文献:
[1] Mellman I, Coukos G, Dranoff G. Cancer immunotherapy comes of age. Nature 2011;480:480e9. http://dx.doi.org/10.1038/nature10673.
[2] Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010;363:711e23. http://dx.doi.org/10.1056/NEJMoa1003466.
[3] Robert C, Long GV, Brady B, Dutriaux C, Maio M, Mortier L,et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015;372:320e30. http://dx.doi.org/10.1056/NEJMoa1412082.
[4]Safety profile of nivolumab (NIVO) in patients (pts) with advanced melanoma (MEL): a pooled analysis. J Clin Oncol n.d.
[5] Ueda H, Howson JMM, Esposito L, Heward J, Snook H,Chamberlain G, et al. Association of the T-cell regulatory gene CTLA4 with susceptibility to autoimmune disease. Nature 2003;423:506e11. http://dx.doi.org/10.1038/nature01621.
[6] Vaidya B, Pearce SHS, Charlton S, Marshall N, Rowan AD,Griffiths ID, et al. An association between the CTLA4 exon 1 polymorphism and early rheumatoid arthritis with autoimmune endocrinopathies. Rheumatol Oxf Engl 2002;41:180e3.
[7] Ueda H, Howson JMM, Esposito L, Heward J, Snook H,Chamberlain G, et al. Association of the T-cell regulatory gene CTLA4 with susceptibility to autoimmune disease. Nature 2003;423:506e11. http://dx.doi.org/10.1038/nature01621.
[8] Zhernakova A, Eerligh P, Barrera P, Wesoly JZ, Weseloy JZ,Huizinga TWJ, et al. CTLA4 is differentially associated with autoimmune diseases in the Dutch population. Hum Genet 2005;118:58e66. http://dx.doi.org/10.1007/s00439-005-0006-z.
[9] Ferna ´ndez-Mestre M, Sa ´nchez K, Balba ´s O, Gendzekhzadze K,Ogando V, Cabrera M, et al. Influence of CTLA-4 gene polymorphism in autoimmune and infectious diseases. Hum Immunol 2009;70:532e5. http://dx.doi.org/10.1016/j.humimm.2009.03.016.
[10] Hudson LL, Rocca K, Song YW, Pandey JP. CTLA-4 gene polymorphisms in systemic lupus erythematosus: a highly significant association with a determinant in the promoter region. Hum Genet 2002;111:452e5. http://dx.doi.org/10.1007/s00439-002-0807-2.
Prokunina L, Castillejo-Lo ´pez C, Oberg F, Gunnarsson I, Berg L,Magnusson V, et al. A regulatory polymorphism in PDCD1 is associated with susceptibility to systemic lupus erythematosus in humans.Nat Genet 2002;32:666e9. http://dx.doi.org/10.1038/ng1020.
[11] Lee YH, Bae S-C, Kim J-H, Song GG. Meta-analysis of genetic polymorphisms in programmed cell death 1: associations with rheumatoid arthritis, ankylosing spondylitis, and type 1 diabetes susceptibility. Z Rheumatol 2015;74:230e9. http://dx.doi.org/10.1007/s00393-014-1415-y.
[12]Ariyasu R 1 , Horiike A 1 , Yoshizawa T 1 , Dotsu Y 1 , Koyama J 1 , Saiki M 1 , Sonoda T 1 , Nishikawa S 1 , Kitazono S 1 , Yanagitani N 1 , Nishio M 2 , Adrenal Insufficiency Related to Anti-Programmed Death-1 Therapy. Anticancer Research [01 Aug 2017, 37(8):4229-4232].
[13]J.M. Michot a,b,c,*,1, C. Bigenwald a,1, S. Champiat b, M. Collins d,e,F. Carbonnel d,e, S. Postel-Vinay b, A. Berdelou a, A. Varga b,R. Bahleda b, A. Hollebecque b, C. Massard b, A. Fuerea a,b, V. Ribrag a,b,A. Gazzah b, J.P. Armand b, N. Amellal b, E. Angevin b, N. Noel c,e,f,g,C. Boutros a,b,c, C. Mateus a,b,c, C. Robert a,b,c, J.C. Soria b,A. Marabelle b, O. Lambotte c,e,f,g,Immune-related adverse events with immune checkpoint blockade: a comprehensive review,European Journal of Cancer 54 (2016) 139e148.
[14] Ribas A, Camacho LH, Lopez-Berestein G, Pavlov D,Bulanhagui CA, Millham R, et al. Antitumor activity in melanoma and anti-self responses in a phase I trial with the anticytotoxic T lymphocyte-associated antigen 4 monoclonal antibody CP-675,206. J Clin Oncol Off J Am Soc Clin Oncol 2005;23:8968e77. http://dx.doi.org/10.1200/JCO.2005.01.109.
[15] Beck KE, Blansfield JA, Tran KQ, Feldman AL, Hughes MS,Royal RE, et al. Enterocolitis in patients with cancer after antibody blockade of cytotoxic T-lymphocyte-associated antigen 4. J Clin Oncol Off J Am Soc Clin Oncol 2006;24:2283e9. http://dx.doi.org/10.1200/JCO.2005.04.5716.
[16]Johnston RL, Lutzky J, Chodhry A, Barkin JS. Cytotoxic Tlymphocyte-associated antigen 4 antibody-induced colitis and its management with infliximab. Dig Dis Sci 2009;54:2538e40. http://dx.doi.org/10.1007/s10620-008-0641-z.
[17] Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC,McDermott DF, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012;366:2443e54.http://dx.doi.org/10.1056/NEJMoa1200690.
[18]Orlov S, Salari F, Kashat L, Walfish PG. Induction of painless thyroiditis in patients receiving programmed death 1 receptor immunotherapy for metastatic malignancies. J Clin Endocrinol Metab 2015;100:1738e41. http://dx.doi.org/10.1210/jc.2014-4560.
[19]Kim KW, Ramaiya NH, Krajewski KM, Jagannathan JP, Tirumani SH, Srivastava A, et al. Ipilimumab associated hepatitis: imaging and clinicopathologic findings. Invest New Drugs 2013;31:1071e7. http://dx.doi.org/10.1007/s10637-013-9939-6.
[20]Johnson PJ, McFarlane IG, Williams R. Azathioprine for long-term maintenance of remission in autoimmune hepatitis. N Engl J Med 1995;333:958e63. http://dx.doi.org/10.1056/NEJM199510123331502.
[21]Nishino M, Sholl LM, Hodi FS, Hatabu H, Ramaiya NH. Anti-PD-1-related pneumonitis during cancer immunotherapy. N Engl J Med 2015;373:288e90. http://dx.doi.org/10.1056/NEJMc1505197.
[22]Merck. Highlights of prescribing information for Keytruda. 2015.
本文仅供医学药学专业人士阅读



















 X
X