接上文…
表 2 汇整试验 1 中发生在至少 10%接受 OPDIVO 治疗者的不良反应。最常见的不良反应(患者 的发生率至少为 20%)为皮疹。
表 2:发生在≥10%接受 OPDIVO 治疗的患者,且发生率高于化学治疗组的特定不良反应(组 间差异≥5%[全部级别]或≥2%[第 3-4 级]) (试验 1)
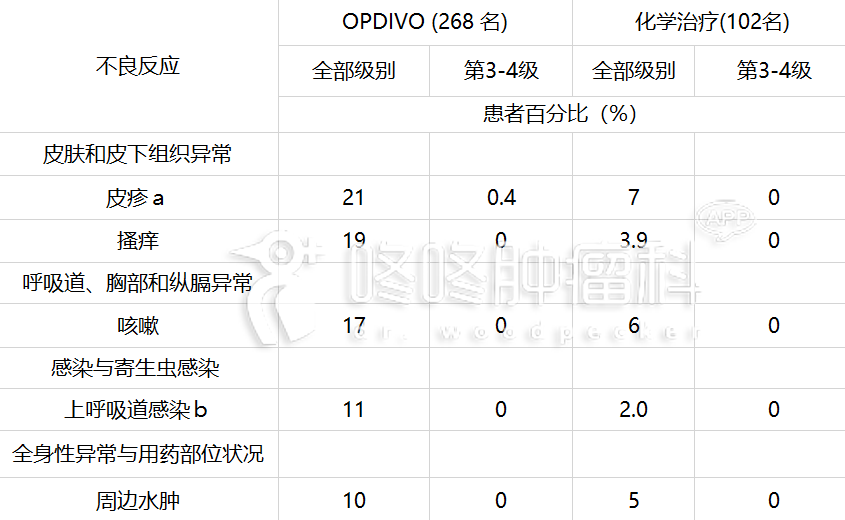
a 皮疹为一总称,其中包括斑丘疹、红斑性皮疹、搔痒性皮疹、滤泡性皮疹、斑疹、丘疹状皮疹、脓疱性皮 疹、水泡性皮疹及痤疮性皮肤炎。
b上呼吸道感染为一总称,其中包括鼻炎、咽炎和鼻咽炎。
试验 1 中接受 OPDIVO 治疗者其发生率少于 10%的其他临床重要不良反应:
心脏异常: 心室性心律不整
眼部异常: 虹膜睫状体炎
全身性异常与用药部位状况: 输注相关反应
各项检查: 淀粉酶增加、脂肪酶增加
神经系统异常: 头晕、周边与感觉神经病变
皮肤和皮下组织异常: 剥落性皮肤炎、多形性红斑、白斑病、干癣。
表 3:发生在≥10%接受 OPDIVO 治疗的患者,且发生率高于化学治疗组的特定实验室检测值 异常(从基期起发生恶化,组间差异≥5%[全部级别]或≥2%[第 3-4 级]) (试验 1)
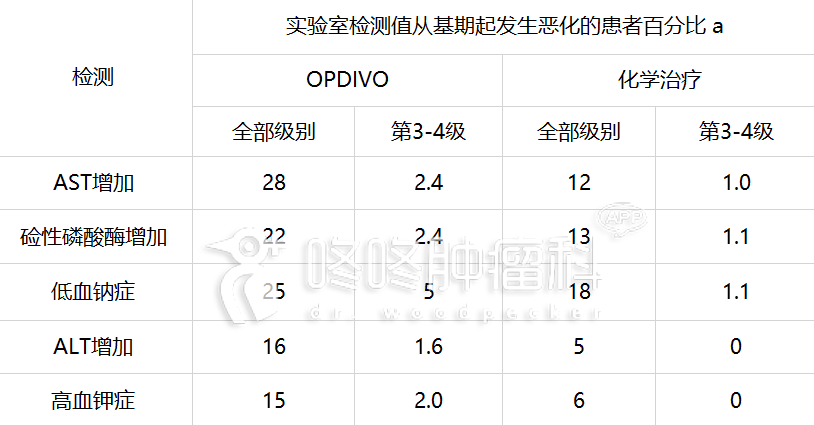
a 每项检测的发生率乃根据可同时提供基期和至少一项试验期间实验室测量值的患者人数:OPDIVO组(范围: 252 至 256 名患者)和化学治疗组(范围:94 至 96 名患者)。
在试验3,一项随机分配、双盲、活性药物对照试验,对象为411名患有无法切除或转移性BRAF V600野生型(wild-type)黑色素瘤且没有接受过治疗的患者,接受每2周一次OPDIVO 3 mg/kg治 疗(206名),或接受每3周一次dacarbazine 1000 mg/m2治疗(205名))[ 请参阅临床研究 ( 第 14.1 节 )] ,也进行过OPDIVO的安全性评估。接受OPDIVO治疗的患者,曝药时间中位数为6.5个月(范围 :1天至16.6个月)。在这项试验中,47%患者使用OPDIVO超过6个月,12%患者使用OPDIVO 长达一年以上。
这项试验排除有自体免疫疾病和需要长期全身性皮质类固醇(> 10 mg/day prednisone或等效剂 量药物)或其他免疫抑制药物治疗的患者。
OPDIVO组及dacarbazine组的试验族群特性相似:59%为男性,年龄中位数为65岁,99.5%为 白人,61%罹患M1c分期疾病,74%罹患皮肤黑色素瘤,11%罹患黏膜黑色素瘤,4%出现脑部 转移和37%在基期时有LDH升高。在OPDIVO组有更多ECOG体能状态分数为0分的患者(71% 相较于59%)
因不良反应导致有7%的患者永久停用OPDIVO,有26%的患者暂时停用OPDIVO;在大多数停 用OPDIVO的患者中并无单一型态的不良反应发生。接受OPDIVO治疗患者的严重不良反应发 生率为36%。接受OPDIVO治疗患者的第3和第4级不良反应发生率为41%。接受OPDIVO治疗 患者最常见的第3和第4级不良反应(发生率至少为2%)包括丙麸氨转肽酶(gammaglutamyltransferase)上升(3.9%)和腹泻(3.4%)。
表 4 汇整发生在 10%以上接受 OPDIVO 治疗患者的特定不良反应。最常见的不良反应(患者的 发生率至少为 20%,且发生率高于 dacarbazine 治疗组)为疲倦、肌肉骨骼疼痛、皮疹和搔痒症。
表 4:发生在≥10%接受 OPDIVO 治疗的患者,且发生率高于 Dacarbazine 组的特定不良反应 (组间差异≥5%[全部级别]或≥2%[第 3-4 级]) (试验 3)
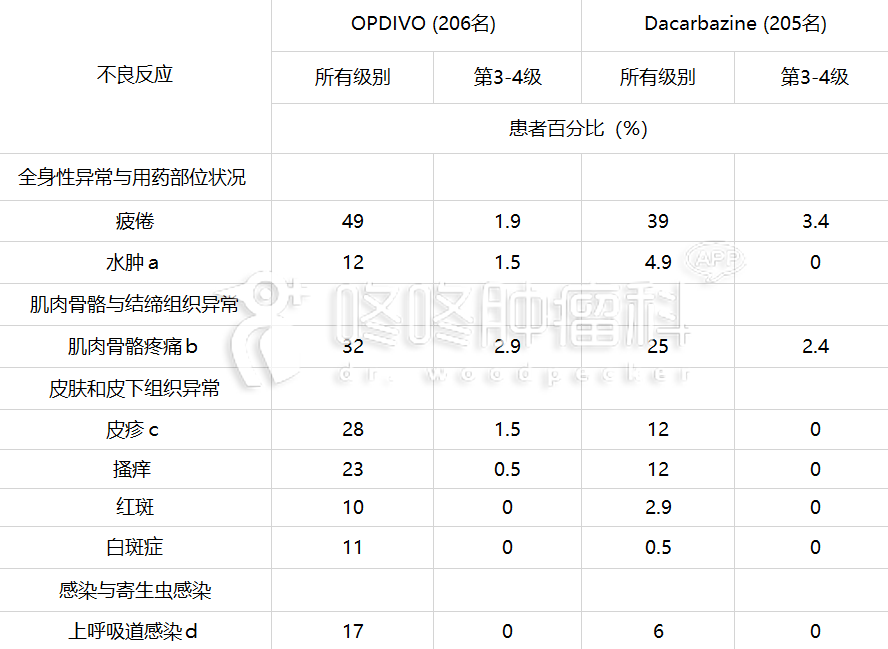
a 包括眼眶周围水肿、脸部水肿、全身性水肿、重力性水肿、局部性水肿、周边水肿、肺水肿和淋巴水 肿。
b 包括背痛、骨头痛、胸部肌肉骨胳疼痛、肌肉骨骼不舒服、肌痛、脖子痛、肢端痛、下巴痛和脊椎痛 。
c 包括斑丘疹、红斑性皮疹、搔痒性皮疹、滤泡性皮疹、斑疹、丘疹状皮疹、脓胞性皮疹、水泡性皮疹 、皮肤炎、过敏性皮肤炎、剥落性皮肤炎、痤疮性皮肤炎、药疹和皮肤反应。 d 包括鼻炎、病毒性鼻炎、咽炎和鼻咽炎。
在试验3中,发生在少于10%接受OPDIVO治疗患者其他临床上重要的不良反应为:
神经系统疾病: 周边神经病变
表 5:发生在≥10%接受 OPDIVO 治疗的患者,且发生率高于 Dacarbazine 治疗组的特定实验 室检测值异常 (从基期起发生恶化,组间差异≥5%[全部级别]或≥2%[第 3-4 级]) (试验 3)
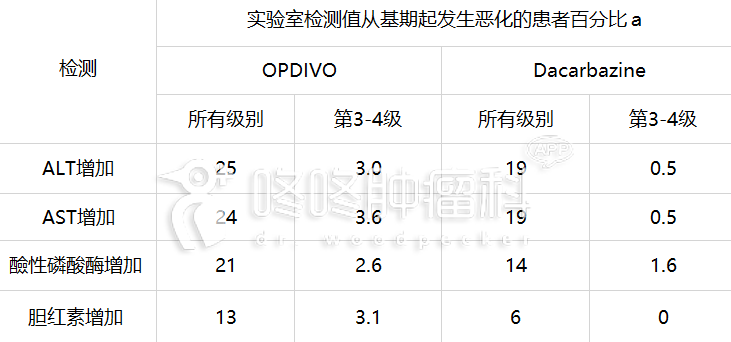
a每一项检测发生率乃根据可同时提供基期和至少一项试验期间实验室测量值的患者人数而得:在 OPDIVO 组(范 围:194 至 197 名患者)和 dacarbazine 组(范围:186 至 193 名患者)
转移性鳞状非小细胞肺癌
已针对曾于接受一次含铂双药化学治疗期间或之后出现疾病恶化的转移性鳞状非小细胞肺癌 患者进行一项随机分配、开放性、多中心试验(试验 2)以评估 OPDIVO 的安全性[ 请参阅临床试 验 (14.2)]。患者每 2 周一次以 60 分钟时间静脉输注 OPDIVO 3 mg/kg (n=131),或每 3 周一次 静脉输注 docetaxel 75 mg/m2 (n=129)。OPDVIO 治疗组患者的治疗期间中位数为 3.3 个月(范 围:1 天至 21.7+个月),docetaxel 治疗组患者为 1.4 个月(范围:1 天至 20.0+个月)。在本试验 中,36%的患者接受 OPDIVO 至少 6 个月,18%的患者接受 OPDIVO 至少 1 年。
试验 2 排除患有自体免疫疾病、需要全身性免疫抑制治疗或患有症状性间质性肺部疾病的患者。
所有随机分配患者的年龄中位数为 63 岁(范围:39 至 85 岁);44%的患者≥65 岁。共有 76%的 随机分配患者为男性(OPDIVO 组 82%,docetaxel 组 71%),93%为白人。族群基期疾病特性为 第 IIIb 期(19%)、第 IV 期(80%)与脑部转移(6%)。基期 ECOG 体能状态分数为 0 分 (OPDIVO 组 20%,docetaxel 组 27%)或 1 分 (OPDIVO 组 79%,docetaxel 组 73%)。
因不良反应停用 OPDIVO 的患者有 11%,因不良反应而延后用药的患者有 27%。接受 OPDIVO 的患者有 47%发生严重不良反应。OPDIVO 治疗患者最常通报发生的严重不良反应(发生率至 少 2%)为恶性肿瘤恶化、肺炎、发热与高血钙症。
试验 2 的最常见的不良反应(至少 20%患者通报发生)为呼吸困难、咳嗽、疲倦与食欲不振。
表 6 汇整了试验 2 中至少 10% OPDIVO 治疗患者发生的较常见特定不良反应
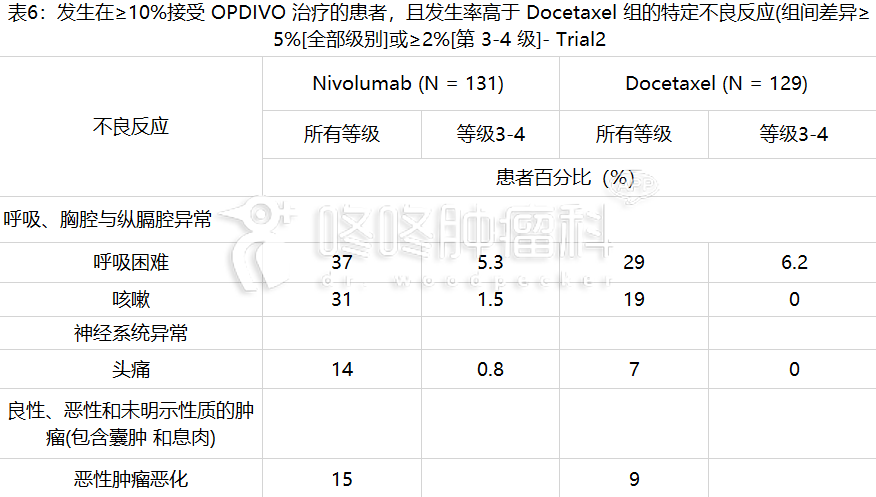
表 7:≥10% OPDIVO 治疗患者发生全部 NCI CTCAE 等级自基期以来恶化以及发生率 高于 Docetaxel (组间差异≥5%[所有等级]或≥2%[等级 3-4])的特定实验室异常(试验 2)
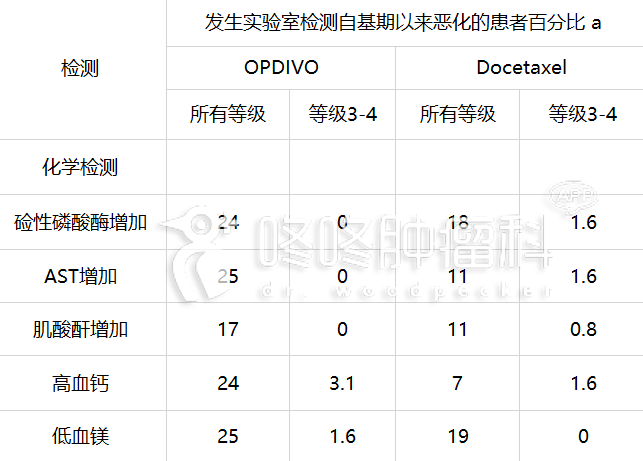
a 每一项检测发生率乃根据可同时提供基期和至少一项试验期间实验室测量值的患者人数而得:在 OPDIVO 组 (范围:125 至 130 个患者)和 docetaxel 组(范围:120 至 128 个患者)
未完待续…
本系列共有6篇文章,在首页搜索栏中输入“opdivo”,一次看全所有内容。
本文仅供医学药学专业人士阅读
















 X
X