自从早期的两款PD-1药物帕博利珠单抗和纳武利尤单抗在国内上市后,尤其是两者在肝癌中同样获批了二线适应症,关于两者之间的比较就一直未停止过。但随着纳武利尤单抗Checkmate-459研究的失败,在与美国FDA协商后,百时美施贵宝自愿撤回Opdivo(纳武利尤单抗)单药作为肝细胞癌(HCC)患者二线治疗的适应症。这也使得,“OK”之争在肝癌单药治疗领域以帕博利珠单抗的胜利而结束!
近日,Keynote-224研究相继公布了两个队列的完整数据,帕博利珠单抗一线/二线治疗晚期肝癌都取得了不错的疗效。而在最新的CSCO指南会上,也将帕博利珠单抗治疗晚期肝癌的证据等级进行了上调。
KEYNOTE-224是一项非随机、多中心、开放标签II期研究,共有两个队列,队列1入组的是既往接受过索拉非尼治疗的晚期aHCC患者;队列2入组的是不适合或难以接受局部区域治疗且之前未接受过全身治疗的aHCC患者。所有患者均接受帕博利珠单抗治疗(200mg/q3w)。
队列1:
帕博利珠单抗二线治疗数据更新
持续的临床获益
对104例患者进行了疗效和安全性评估。首次给药至数据截止的中位时间为45.1个月。
盲法独立审查委员会(BICR)根据RECISTv1.1标准评估的客观反应,即ORR为18.3%,其中完全缓解(CR)为3.8%,部分缓解(PR)为14.4%;DCR为61.5%。BICR根据mRECIST标准评估的ORR为16.3%,根据irRECIST标准评估为18.3%(19/104),研究者根据RECIST v1.1评估的ORR为13.5%(14/104)。
中位DoR为21.0个月,77%的患者DOR≥12个月。在5例患者中观察到持续缓解时间≥24个月,在数据截止时,19例患者中有2例持续缓解(均为PR),最长缓解时间为39.5个月。
BICR根据RECIST v1.1评估的中位PFS为4.9个月,24个月时,PFS率为11.3%;中位TTP为4.8个月,估计24个月的TTP率为21.8%;BICR根据mRECIST标准评估的mPFS为3.1个月,根据irRECIST标准评估为6.7个月。研究者根据RECISTv1.1评估的中位PFS为3.1个月,24个月的PFS率为10.6%。
中位OS为13.2个月,24个月的OS率为30.8%。在第一次扫描后有反应者与第一次扫描无反应者中,有应答者的中位OS未达到,无应答者的中位OS为10.3个月。
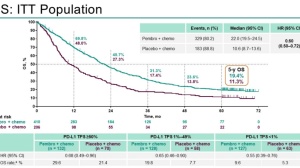
在队列1中额外随访约2.5年后,帕博利珠单抗继续在先前接受过索拉非尼治疗的晚期HCC患者中提供持久的抗肿瘤活性,安全性与初步分析一致。但该结果受到II期,开放标签和单臂设计的限制。最近,KEYNOTE-394 研究达到了其主要终点,显示与安慰剂加 BSC 相比,帕博利珠单抗加 BSC 作为亚洲晚期肝细胞癌患者的二线治疗,OS 有统计学意义和临床意义的改善。在中位随访34个月后,帕博利珠单抗的中位OS为15个月,而安慰剂为13个月(p = 0.0180)。还观察到次要终点PFS和ORR的显著改善(中位PFS:2.6 vs 2.3个月,p= 0.0032;ORR:12.7% vs 1.3%,p<0.0001)。也是基于此,CSCO肝癌诊疗指南将其证据等级上升为1A类证据。
队列2:
一线单药治疗晚期肝癌结果积极
已获NCCN推荐
2018年9月4日至2019年2月20日,纳入51例患者。从第一次给药到数据截止(2021年1月19日)的中位时间为27个月。
51例患者中有8例观察到客观缓解,ORR为16%,8例患者均有部分缓解。另外21例患者病情稳定,DCR为57%。中位DOR为16个月。在8名确认应答的应答者中,50%的人在数据截止日期仍有应答,73%的应答者至少持续反应12个月。
在数据截止时,根据RECIST 1.1的中心成像复查,中位TTP为4个月(95% CI, 3-9),中位PFS为4个月(95% CI, 2-8)。12个月的估计PFS率为28%。在51例患者中,34例(67%)死亡。中位OS为17个月(95% CI, 8-23),12个月的OS为58%。
该队列研究结果显示,帕博利珠单抗单药治疗对既往未接受过全身治疗的晚期HCC患者提供了持久的抗肿瘤活性和有希望的总生存期。也是基于这一研究结果,在最新版NCCN指南中,新增了帕博利珠单抗单药治疗(2B类证据)。
作为一种大分子单抗类药物,能够高选择性地结合癌细胞或免疫细胞表面的免疫检查点PD-1,从而释放被PD-1抑制的免疫功能,增强机体抗肿瘤免疫应答,起到强力抗癌的作用。尽管在验证性Kteynote-240研究中,帕博利珠单抗取得了阴性结果,但是其在亚洲患者中进行的KEYNOTE-394研究却取得了阳性结果,这也是FDA的肿瘤药物咨询委员会以8:0的结果赞成了帕博利珠单抗肝癌二线适应症的加速批准的一个原因。而纳武利尤单抗在获得加速审批后,进行的CheckMate-459同样取得了阴性结果,但并未有其他阳性研究结果来佐证纳武利尤单抗单药治疗在晚期肝癌一线/二线中的有效性,这也许是纳武利尤单抗撤回肝癌适应症的一大原因。
尽管迟于纳武利尤单抗上市,但帕博利珠单抗已实现其在肝癌领域的弯道超车。当然两款药物在肝癌领域仍然在开展相关研究,包括联合靶向药物或局部治疗方案,我们也期待听到更多的好消息!
本文仅供医学药学专业人士阅读



.jpg-pd13)












 X
X