上周国内的肿瘤圈像关注球赛一样关注着美国FDA,因为一项划时代的科学技术CAR-T迎来了FDA肿瘤药物专家咨询委员会(ODAC)评审,下面的这位小姑娘Emily Whitehead也被更多的读者所认识。
 12岁的Emily Whitehead和父母一起出现在FDA的CAR-T听证会上
12岁的Emily Whitehead和父母一起出现在FDA的CAR-T听证会上
CAR-T批准用于针对3-25岁的复发或难治性B细胞急淋白血病
这位首个“吃CAR-T螃蟹”的小女孩名叫Emily Whitehead,今年12岁,5岁那年被诊断为急性白血病,在第16个月的化疗过程中复发,之后医生劝其父母放弃,随后入组CAR-T临床试验,成为全球第一个使用该疗法的人。当天,Emily跟其父母一起来到听证会现场为这个拯救了她生命的技术站台。
美国时间7月12日,ODAC以10:0的投票结果一致推荐批准诺华CAR-T疗法Tisagenlecleucel(CTL-019)上市,这是首例从基因层面改变患者自身细胞进而对抗癌症的治疗方法。

CAR-T工作流程示意图:
①从癌症患者身上分离T细胞
②改造T细胞,并加入嵌合抗体后成为CAR-T,功能是识别肿瘤细胞并激活T细胞杀死肿瘤
③体外大量扩增CAR-T细胞
④CAR-T细胞回输到患者体内,密切监控副作用。
为使用这种技术,必须为每位患者创建一个单独的治疗方案 – 将其细胞在批准的医疗中心取出,冷冻,运往诺华工厂解冻和加工,然后再次冷冻并运回治疗中心。最后形成的“活药”对于因其它治疗失败而面临死亡的许多患者带来长久的缓解,且可能是治愈。
审批文件显示,Study B2202入组的88例急淋患者中,63例在美国完成CAR-T输注。63例患者中,52例产生应答(完全缓解CR或者未完全恢复的CR),其中40例子啊书诸侯的前3个月内实现完全缓解,目前中位随访时间是4.8个月,中位缓解持续时间数据还未获得,见下图深绿色皆表示CR,荧光绿表示未完全恢复的CR。

Study B2202 缓解持续时间
当CAR-T遇到实体瘤
看到CAR-T技术在血液肿瘤中的大显身手,总体约占90%比例的实体瘤自然也是跃跃欲试。但一番搜索之后我们会发现,所有资料都导向这样一个结果:目前CAR-T在实体瘤上的试验数据并不乐观。

上图为免疫抑制性的肿瘤微环境。它描绘了一个简化版的CAR-T细胞在进入实体瘤时会遇到的负面元素,而这些元素(如免疫抑制性的免疫细胞、髓性抑制细胞、调节性T细胞等)则会让T细胞失活,在实体瘤中快速抵消T细胞的抗肿瘤作用,造成CAR-T失灵。
我们知道CAR-T的形成简单来说是T细胞加上特异性靶标抗原(仅表达于某种肿瘤细胞表面而不存在于正常细胞上的新抗原),但这种“特异性”特异到何种程度其实很难界定,实际上它们或多或少地表达与正常组织器官中,在CAR-T攻击实体肿瘤细胞的同时,对正常组织的杀伤不可避免。因为实体瘤本身就起源于正常组织的上皮细胞,只是后期因为DNA突变增殖不可控形成肿瘤。
为尽可能规避对正常组织的副作用,2016年宾大Perelman医学院还提出了双靶点CAR-T作用于淋巴瘤和胰腺癌的小鼠实验。被改造的T细胞可以同时识别两种抗原A和B,只有同时表达A和B的细胞才会被杀死,而仅表达一种的不会。

另外一个很重要的点,CAR-T CD19之所以在B细胞急淋上作用明显是因为CD19广泛在多种B细胞恶性肿瘤细胞表面,而在其他组织和血液细胞没有表达,因此是CAR-T治疗B细胞肿瘤的理想靶点。作为肿瘤异质性极强的实体瘤,找到特异性抗原(仅表达于某种肿瘤细胞表面而不存在于正常细胞上的新抗原)就是个老大难。
肿瘤异质性是恶性肿瘤的特征之一,指肿瘤在生长过程中因为多次分裂增殖,其自细胞呈现出分子生物学或基因方面的改变,从而使每个人的肿瘤在不同的生长阶段以及不同区域的生长速度、侵袭能力、药物敏感性、预后等方面都产生差异,因此怎么找到所谓的靶标装在T细胞上真是个问题。

《Nature》期刊曾对对肿瘤异质性做了详述
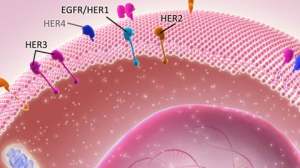
目前,全球临床试验针对的实体瘤靶向抗原包括CEA(消化道肿瘤)、FAP(肝癌)、HER2(乳腺癌、卵巢癌、子宫内膜癌、输卵管癌、胃癌、前列腺癌)、间皮素(胰腺癌、卵巢癌)、GD2(神经母细胞瘤)等,但可惜目前这些临床试验的数据都不太鼓舞人心。
CAR-T与实体瘤的正面交锋就没成功过?
2016年底,《新英格兰医学杂志》上发表了CAR-T在实体瘤当中的首次突破。接受治疗的是一位50岁男性胶质母细胞瘤患者,他的父亲10年前因为胶质母细胞瘤去世。患者已接受过手术切除、化疗及放疗但肿瘤依然存在,脑内有5个肿瘤,于是他加入了City of Hope医院的I期临床研究(NCT02208362)。
研究人员往T细胞里加入的靶向抗原为IL13Rα2,是一种脑瘤中的常见受体,回输方法是脑室内直接注射。第一次治疗持续了6周,之后虽然注射点并在再没有变大,但仍然有占位,而且其它四个肿瘤都有增长,而且患者还出现了脊柱多发转移。

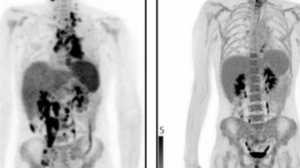
患者本人接受CAR-T颅内注射
研究者认为CAR-T IL13Rα2还是起到了组织肿瘤生长的作用,只不过左右仅在注射点局部,没能远端控制。在此基础上研究者开始第二次治疗,先后在脑室进行了10次注射。当进行到第三次后(133天),发现患者脑内和脊柱内的所有肿瘤都缩小了;而在第5次(190天)注射后,部分肿瘤消失了,而剩下的部分也减少了77%;当进行完全部的10次后,研究人员发现患者体内的肿瘤全部消失!

CAR-T细胞消灭肿瘤细胞的过程
充满戏剧性的结果背后,患者自己没想到自己竟然能够挺过这一关。不过当试验继续往前推荐到了7.5个月时,研究人员在4个新的位置发现复发。稍感安慰的是,新病灶的出现于前7个病灶相隔甚远,说明CAR-T IL13Rα2所产生的抗体还是起到了作用。而对于复发原因,初步的结果显示:IL13Rα2表达量减少。因此如何在CAR-T细胞被输入患者体内后保持其长时间的活性也是我们面临的问题。
CAR-T应用于实体瘤的试验方向
目前CAR-T技术在实体瘤上的应用还是以尝试为主,虽然现在结果不明显,但上升空间依然存在。国内外开展的CAR-T应用于实体瘤的临床试验真不少,如靶向GPC3肝癌、靶向EphA2阳性恶性胶质瘤中、靶向EGFRvIII胶质母细胞瘤中、以及靶向MUC1、HER2的阳性实体瘤的CAR-T治疗都在招募中。

找到合适靶标、克服免疫抑制的肿瘤微环境、增强临床受益的同时控制副作用将会是CAR-T在实体瘤应用的努力方向。
本文仅供医学药学专业人士阅读














 X
X