我们前面了解到了放化疗和TKI在肺癌脑转移中的疗效比较,今天一起来看一下肺癌各个疗法联合治疗会碰撞出什么火花吧!
演讲二:EGFR—TKI的联合治疗探讨
嘉宾:河南省肿瘤医院 王慧娟教授


王教授首先介绍了肺癌的地区差异,在美国的WCLC会议上,免疫治疗的会场总是挤满了人,而中国的靶向治疗专场则很受欢迎,因为美国肺癌患者的突变率太低了。而中国的肺癌突变率却很高,仅仅是EGFR基因的突变率就达到34%左右。因此,我们必须用好TKI,它直接关系着病人生存的获益。
目前一代有3个TKI药物已经上市了,二代的阿法替尼2017年马上要上市,三代的奥西替尼上市也指日可待。那我们为什么还要谈联合治疗呢?这是由我国药物的可及性来决定的,在CSCO指南的可选策略里面标注了,对于EFGR突变阳性的患者可以选择靶向药联合化疗或者抗血管生存治疗。王教授的演讲将主要介绍联合治疗能否给患者带来更好的获益。
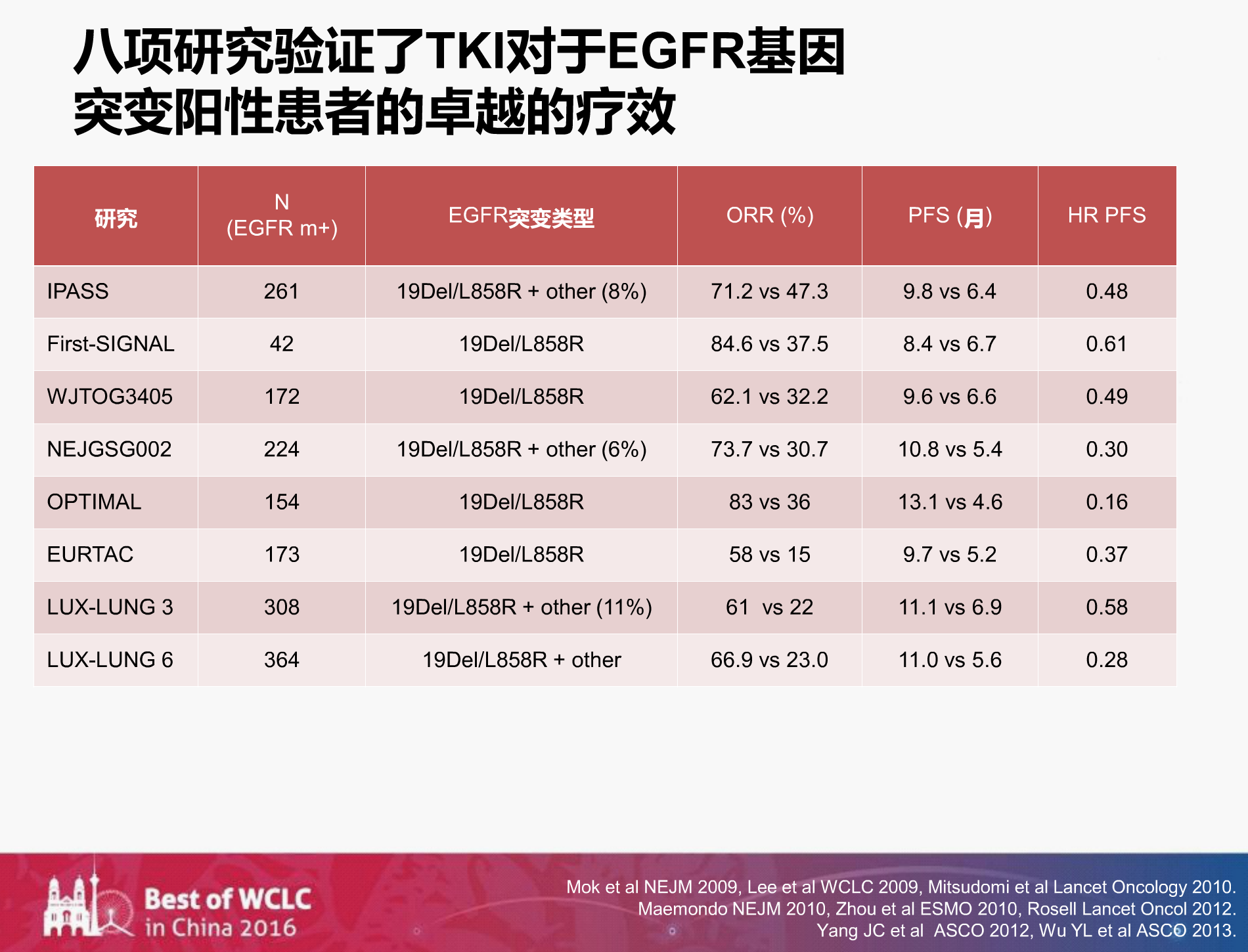
如上图?,八大研究证实了TKI对于EFGR基因突变阳性患者的卓越疗效,但靶向治疗一般在10个月左右就会耐药。很多研究都在关注耐药之后怎么办,王教授提出我们能否将耐药的时间延后?
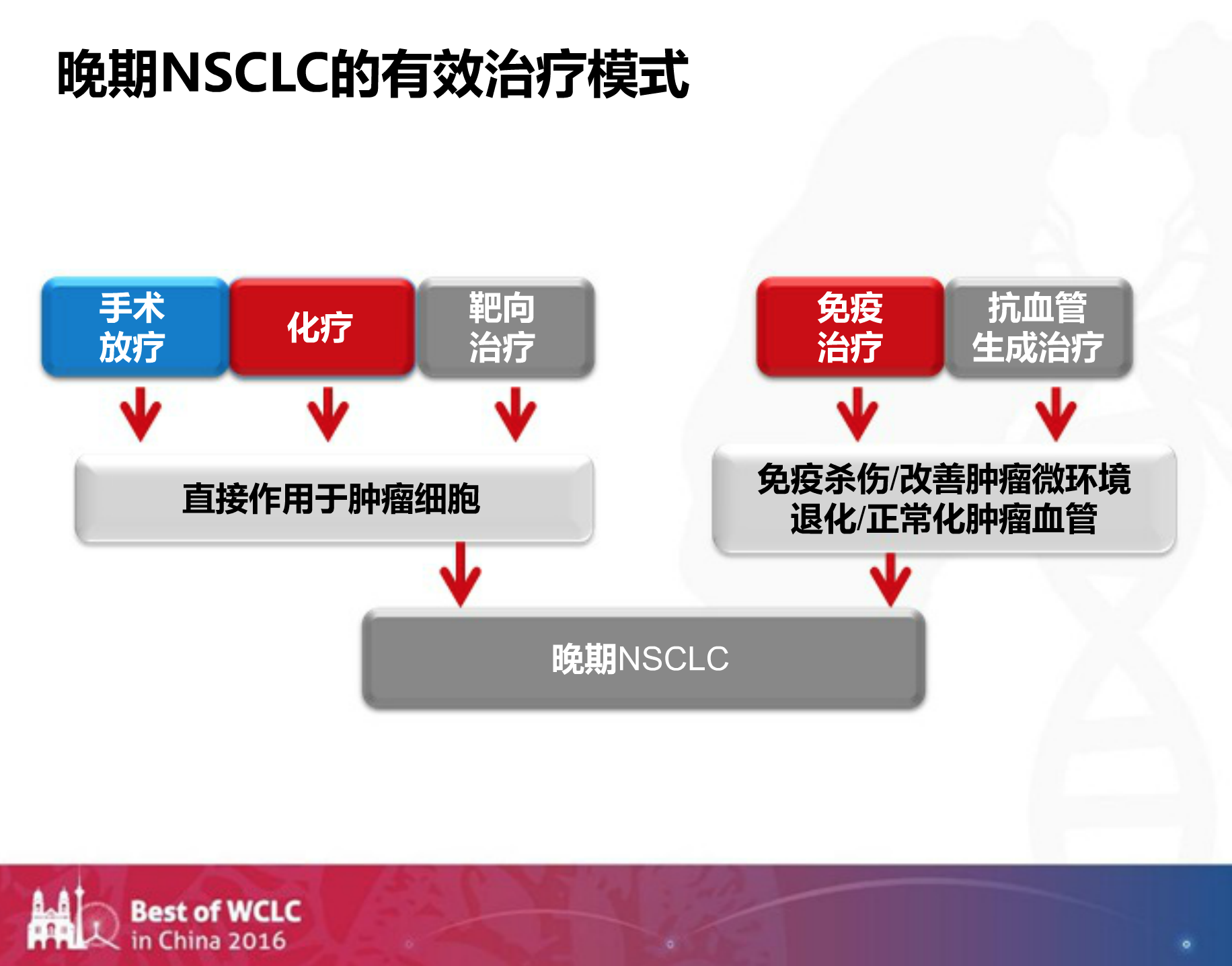
手术和放疗是局部治疗的手段,和靶向治疗联合的作用有限。在全身治疗中还有化疗以及针对肿瘤微环境的免疫治疗及抗血管生成治疗。那么,我们将这些策略和靶向治疗联合的话,它们之间是否会起到化学反应,使TKI发挥作用的时间更长呢?
以往我们有很多失败的经验,在易瑞沙和特罗凯刚上市的时候,对非选择的人群采用化疗联合TKI是一个阴性的结果。当时就有基础研究认为,由于TKI诱导肿瘤细胞停滞于G1期,同时联用影响了化疗药物的疗效,交替治疗或许可以克服这一机制。

中国也发起了FAST-ACT2的研究,这个研究针对的并不是EGFR突变阳性的患者,而是考虑在未经选择的人群里面,EGFR-TKI与化疗交替治疗能否获得更好的疗效。
这个研究的主要终点是PFS,次要终点包括OS及ORR等。研究结果显示,EGFR-TKI厄洛替尼和化疗交替治疗组的PFS比化疗组延长了1.6个月,存在统计学差异。
而有50%的患者进行基因检测之后发现,真正从交替治疗中获益的是存在EGFR突变的人群。将存在EGFR突变的人群进行再次分析发现,厄洛替尼和化疗交替治疗组的PFS比化疗组延长将近10个月,OS延长10.8个月,存在统计学差异。
王教授提到,如果这个研究当时定位的是EGFR突变的人群,达到OS阳性的结果,那么它当时有可能改变我们现有的临床实践。
随着上述FAST-ACT2等对TKI治疗研究的进步,关于化疗和TKI联合的研究也在不断进步。

培美曲塞是近年来肺癌领域非常常用的化疗药,它的主要适用人群是腺癌患者,并且其副作用非常小。在基础研究中也已经证实,培美曲塞和TKI联合,同步或者序贯治疗有增效的优势。
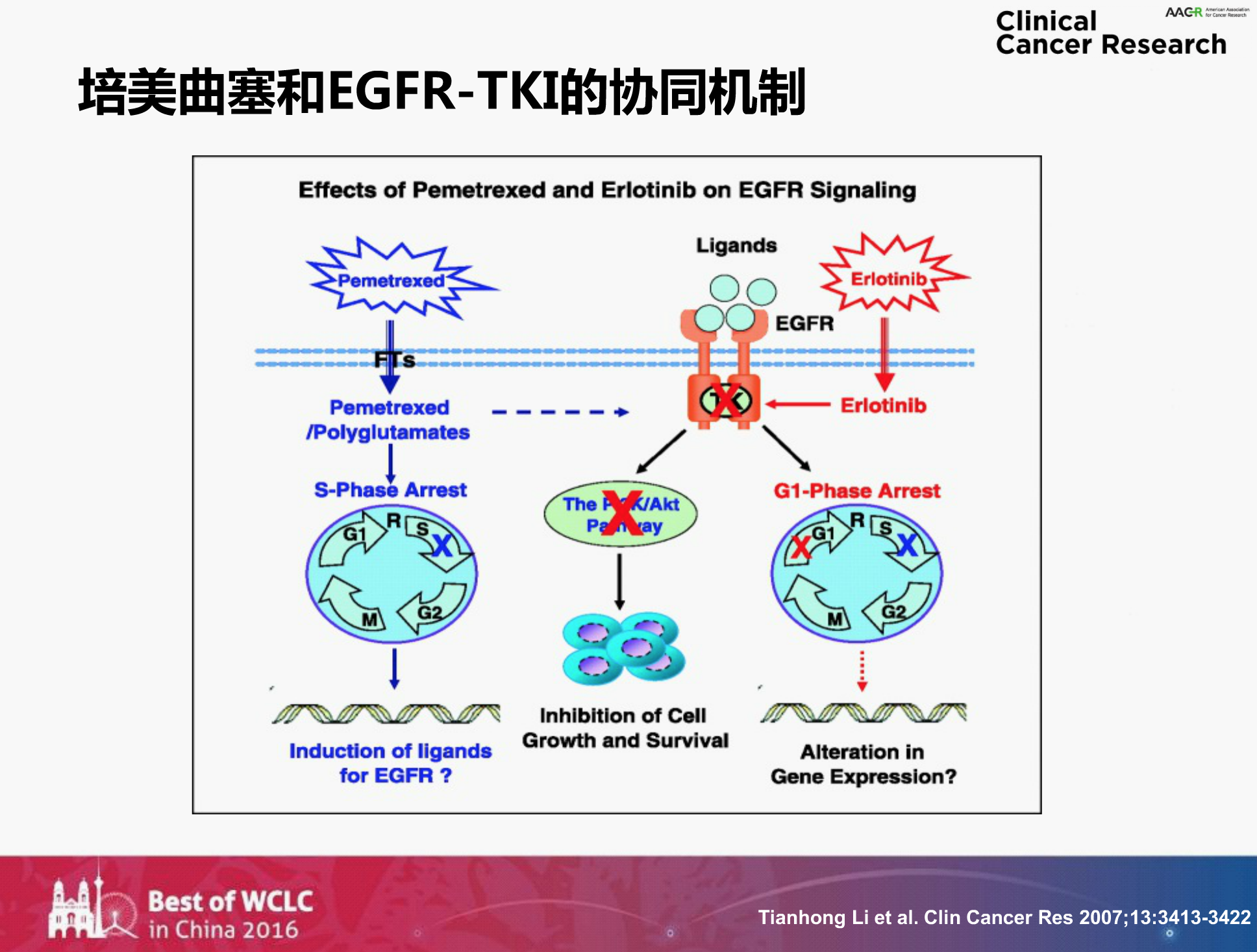
在JIMIT研究中,吉非替尼联合培美曲塞组的PFS比吉非替尼单药组延长4.9个月。
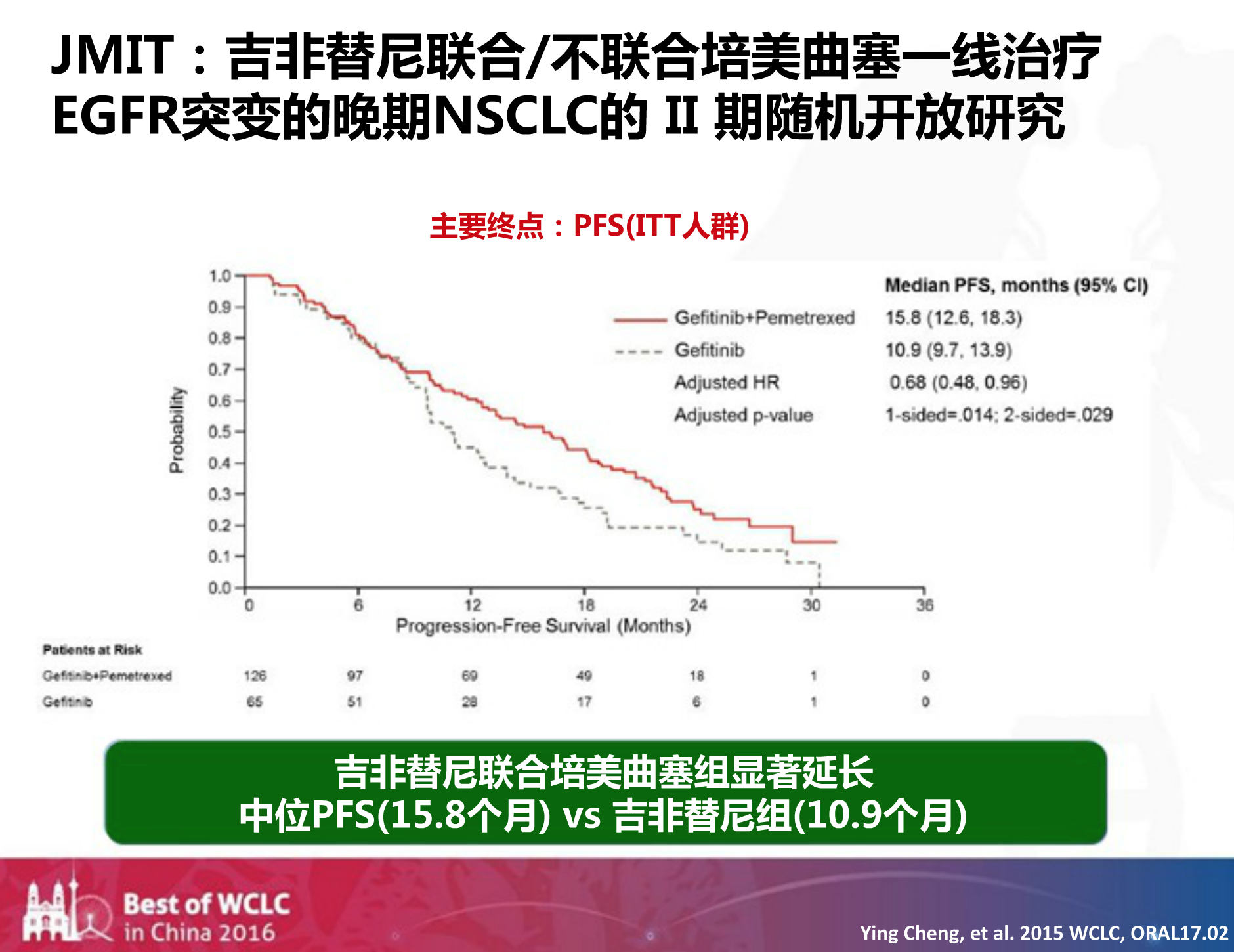
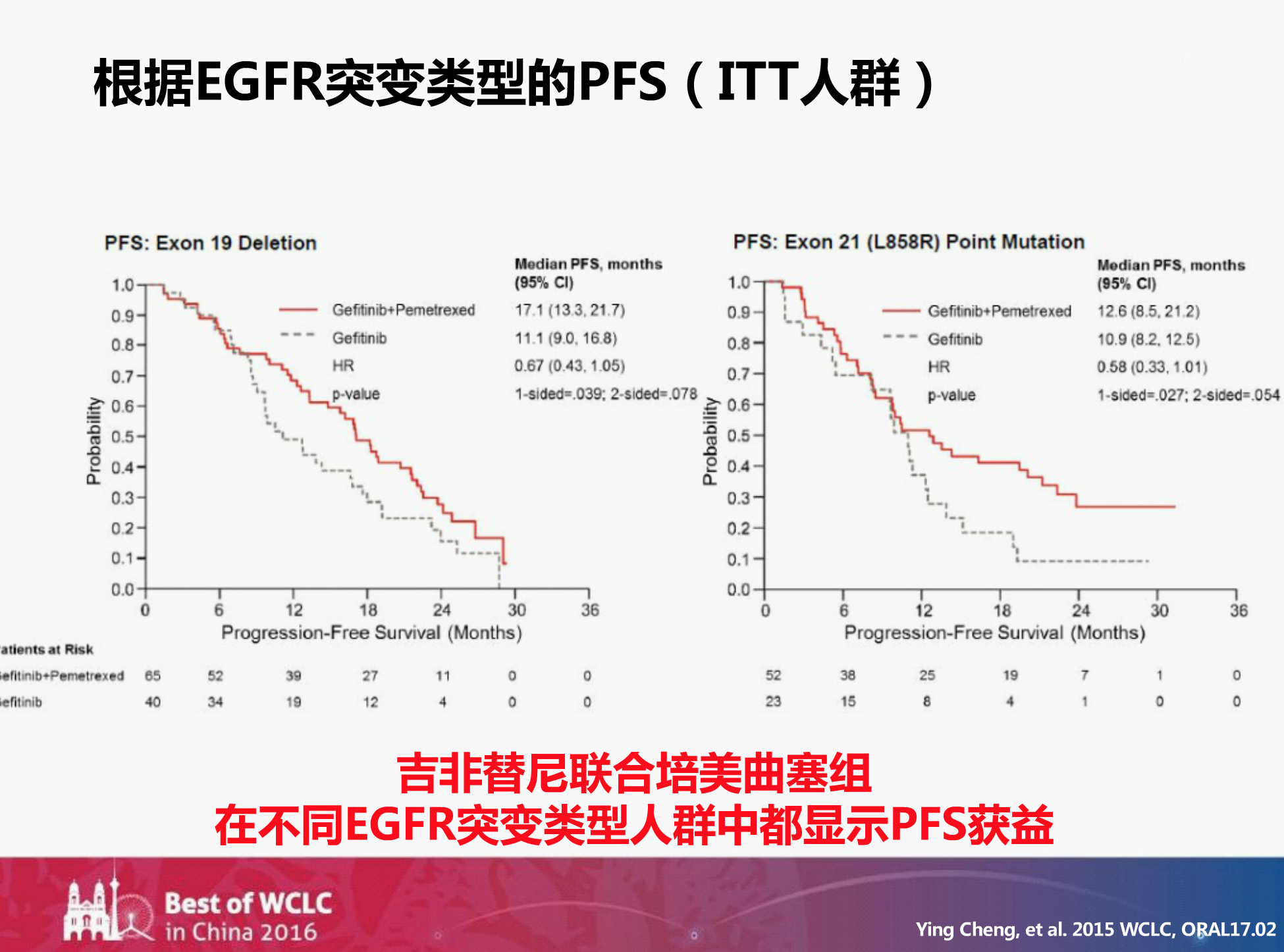
此外,不管是19外显子缺失突变还是21外显子L858R点突变类型,吉非替尼联合培美曲塞组的PFS都显示获益,其中19外显子缺失突变组的PFS表现更出色?。
在2016年的欧洲肺癌大会(ELCC)上,一项中国单中心的研究非常有意思。该研究选择了EGFR突变的人群,随机分为三组:培美曲塞+卡铂+吉非替尼组,吉非替尼单药组,培美曲塞+卡铂组。
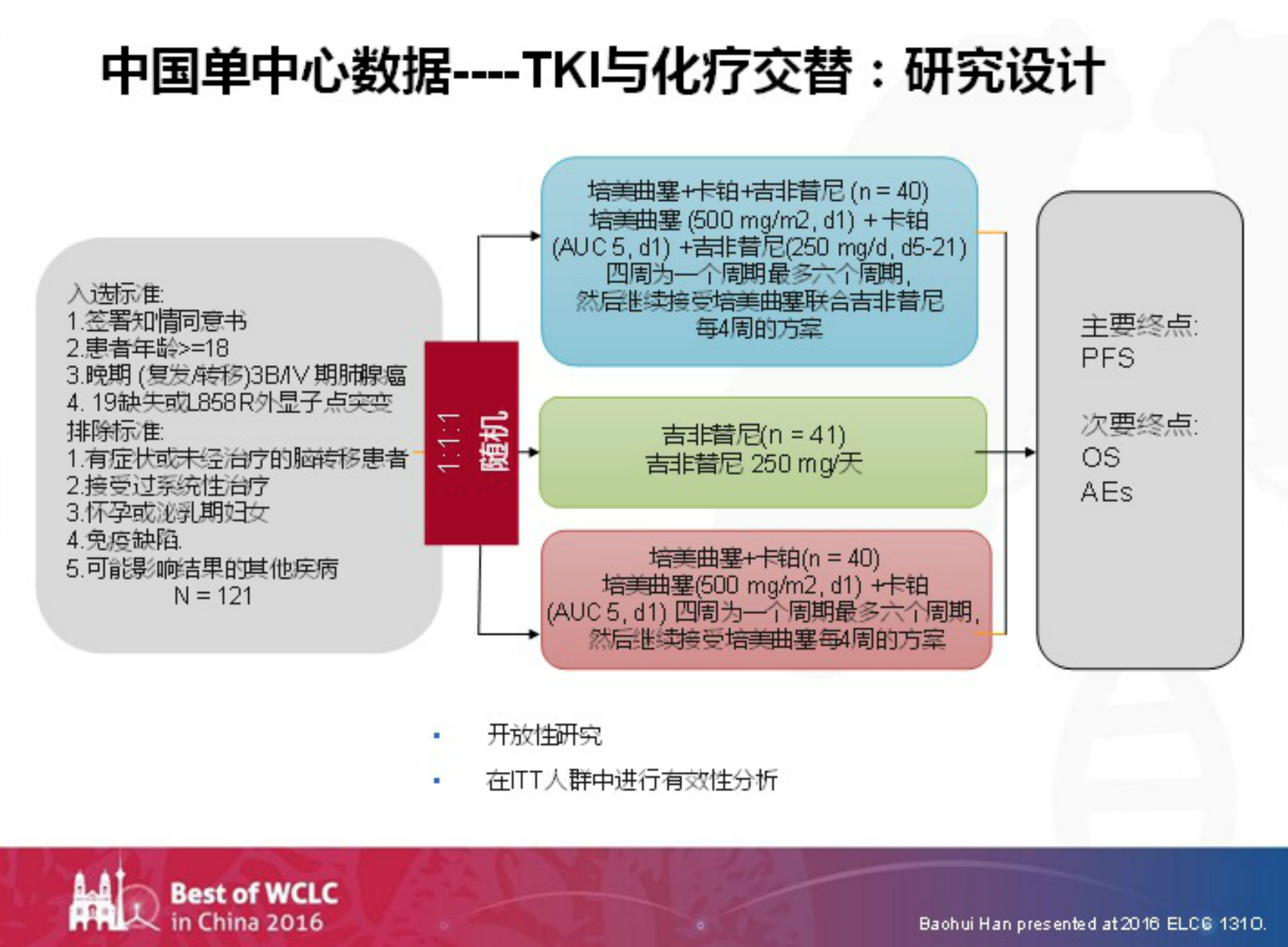
从客观缓解率来看,培美曲塞+卡铂+吉非替尼组优于吉非替尼组,双药化疗组最低。

从PFS来看,双药联合吉非替尼组的PFS能达到18.83个月,吉非替尼单药组为12个月,而双药化疗组只有5.75个月,双药联合吉非替尼组完胜。
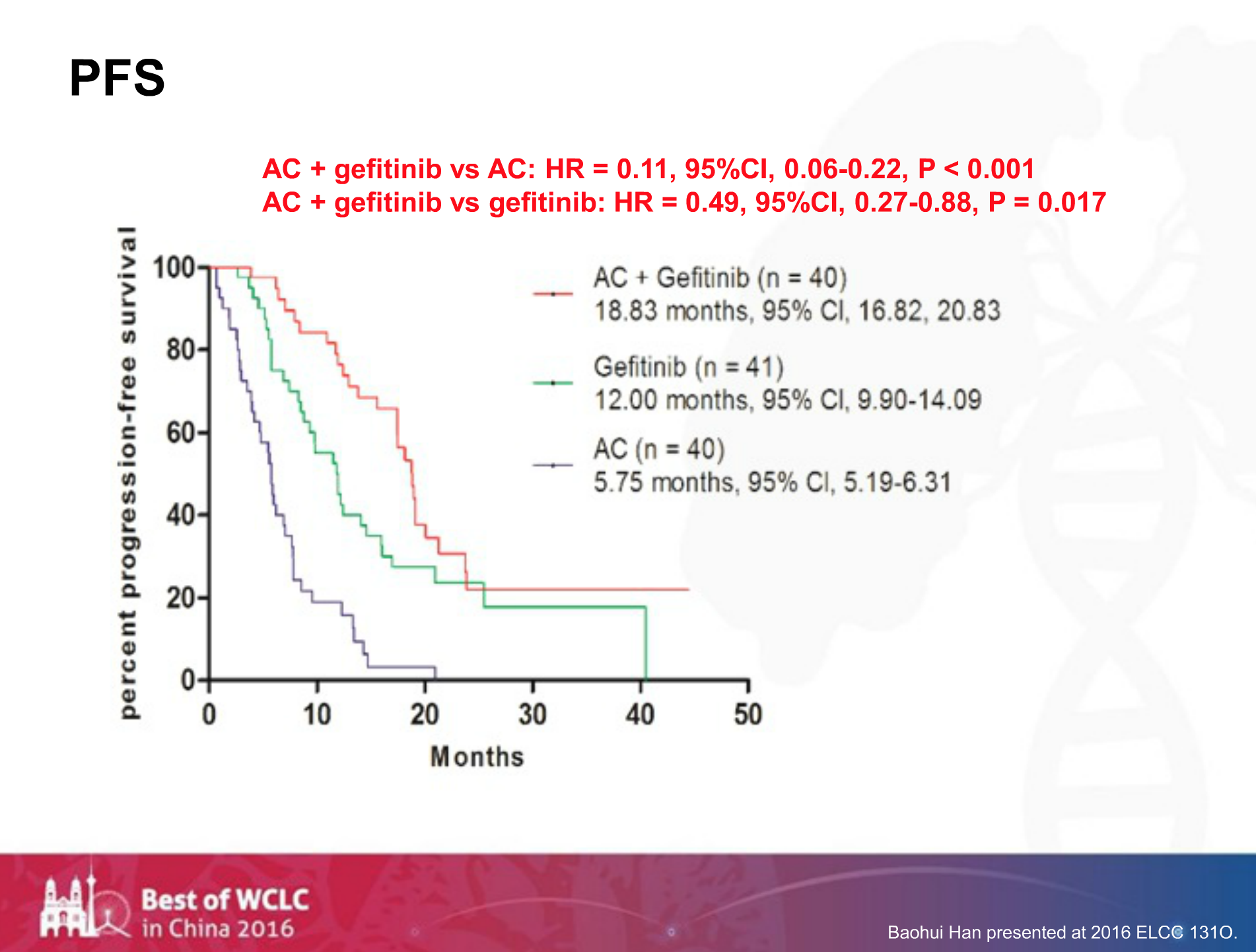
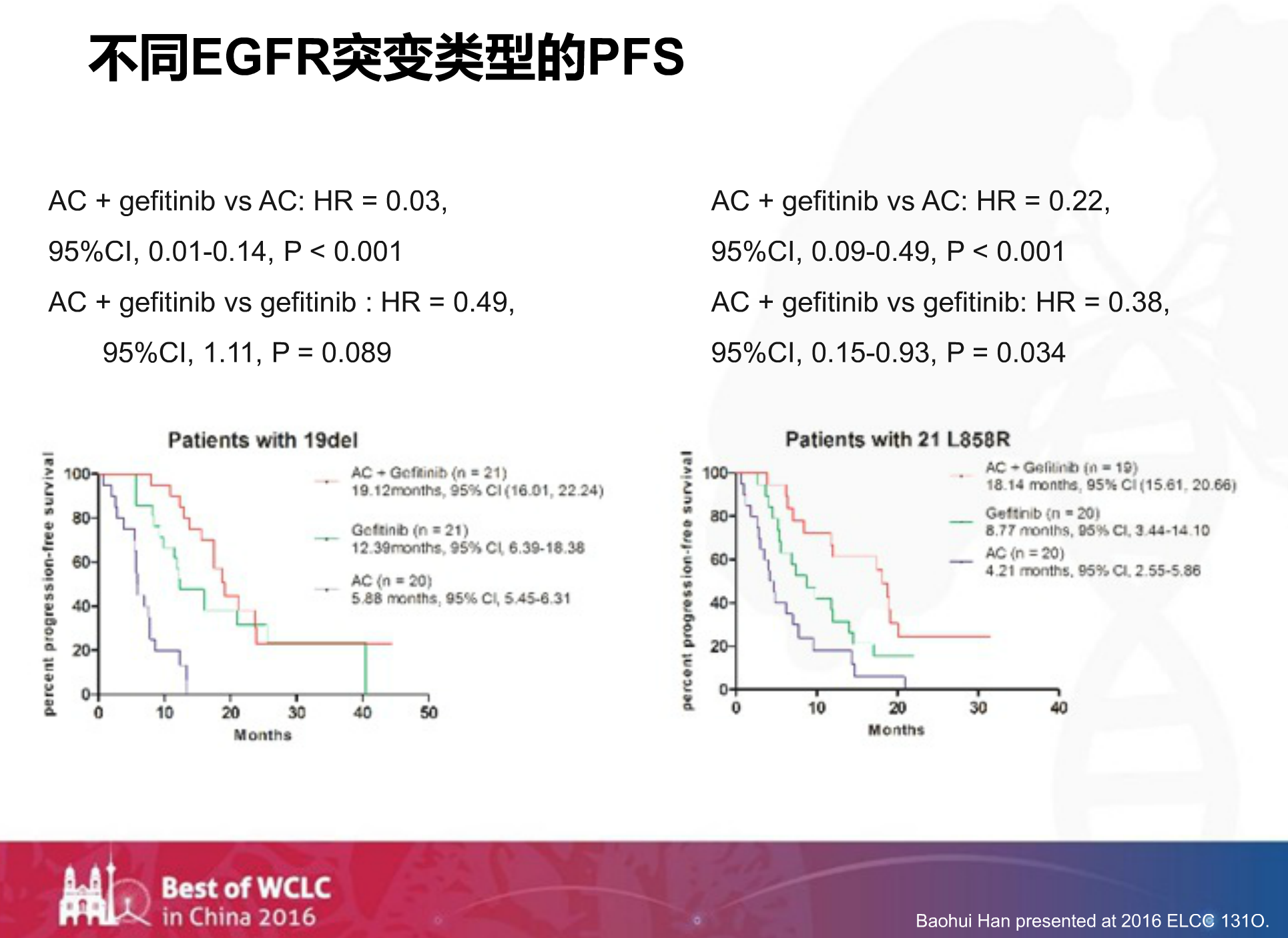
再来看不同EGFR突变类型,对于21外显子突变组,双药联合吉非替尼的PFS比单用吉非替尼延长了近10个月。
王教授提到,这给我们的启示是:对于19外显子突变的患者,我们只用吉非替尼加上培美曲塞就可以了;而对于21外显子突变的患者,我们可以推荐培美曲塞加上卡铂再联合吉非替尼。
王教授接下来对EFGR-TKI联合化疗治疗突变型NSCLC研究进行了汇总介绍:对于初治EFGR突变的晚期NSCLC,一线TKI单药的客观缓解率约为60%,而一线TKI联合化疗的客观缓解率能达到80%左右,PFS为16-18个月,比单药TKI的PFS延长了约6个月。因此,在中国二代和三代TKI还尚未可及的情况下,我们更应该把一线的治疗做得更好,一线TKI联合化疗这种治疗模式是值得推广的。

2016年在肿瘤领域一个非常重要的话题是关于肿瘤微环境的。目前用于对抗肿瘤微环境的改变,临床上有4种方案:抗肿瘤血管生成治疗、免疫激活治疗、复极或对TME内细胞驯化治疗、改变免疫细胞募集、扩大和消耗。但目前我们能用到的手段只有抗血管生成治疗和免疫激活治疗。
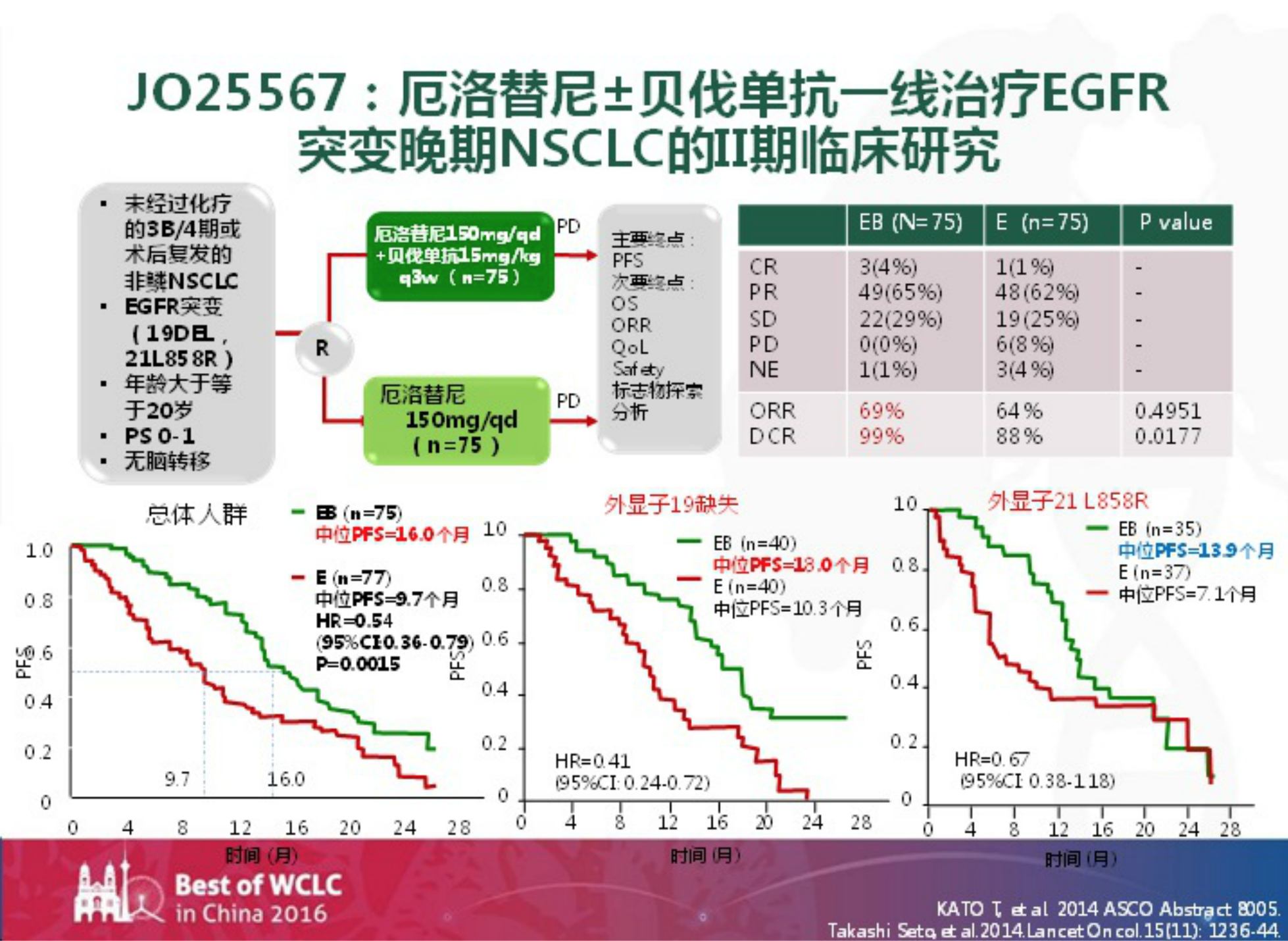
在JO25567研究中,厄洛替尼联合贝伐单抗(抗血管生成治疗)一线治疗EFGR突变晚期NSCLC的中位PFS为16个月,和上述TKI联合化疗组的中位PFS基本一致。而厄洛替尼单药组的中位PFS只有9.7个月,联合治疗组的中位PFS延长了近7个月的时间。
我们还看到,不管是19外显子突变组还是21外显子突变组,这种联合模式都是有效的。但和化疗联合不同的是,抗血管生成治疗并不提高疗效,它起效慢,因此在客观缓解率上和单药治疗组没有很大的差异。它的主要优势在于提高疾病控制率,能够尽可能地延后疾病进展的时间。
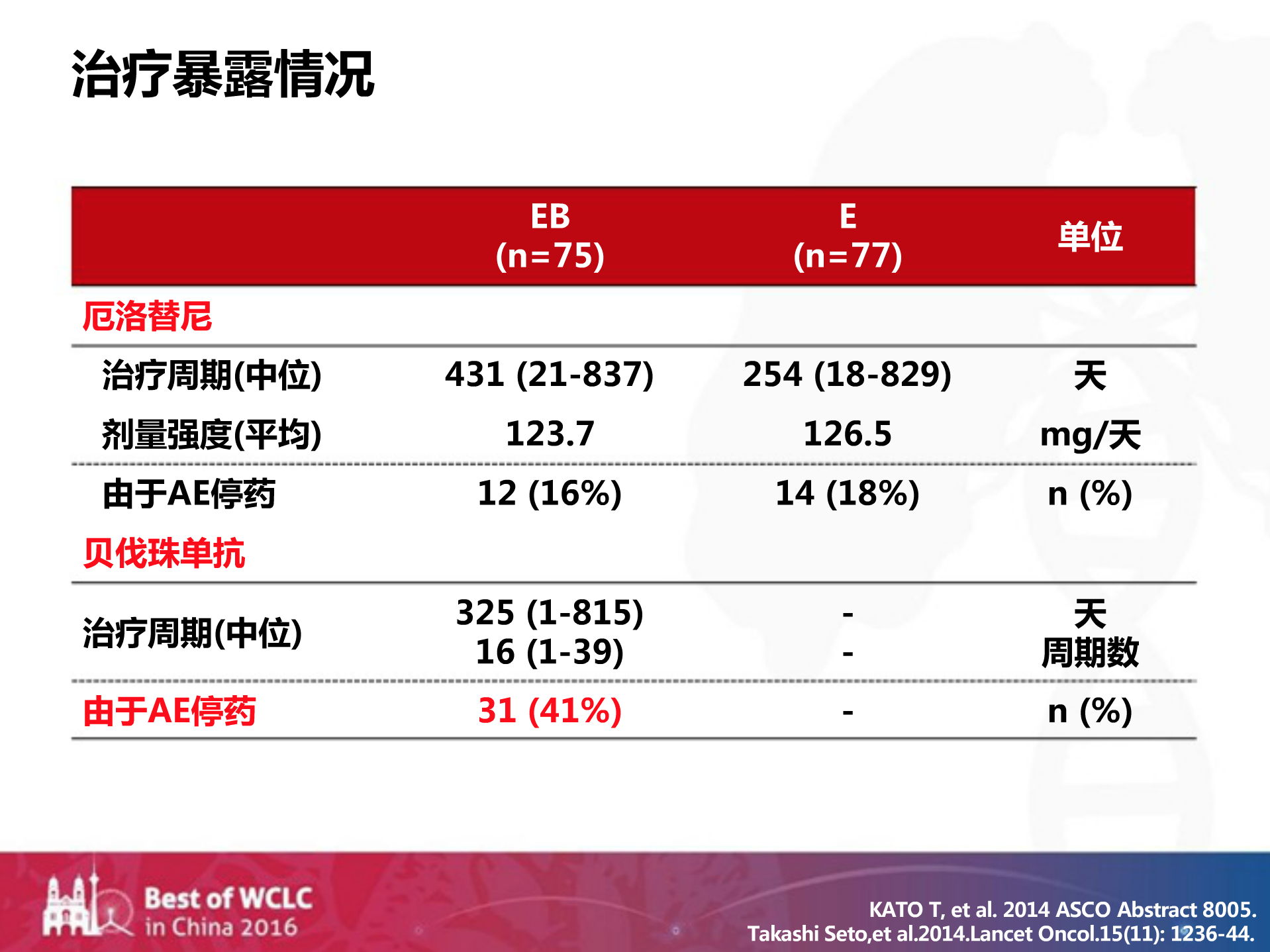
但联合治疗组还有个非常重要的问题,有41%的患者是由于不良反应停药的,因此TKI联合抗血管生成治疗组的毒性是不容忽视的。
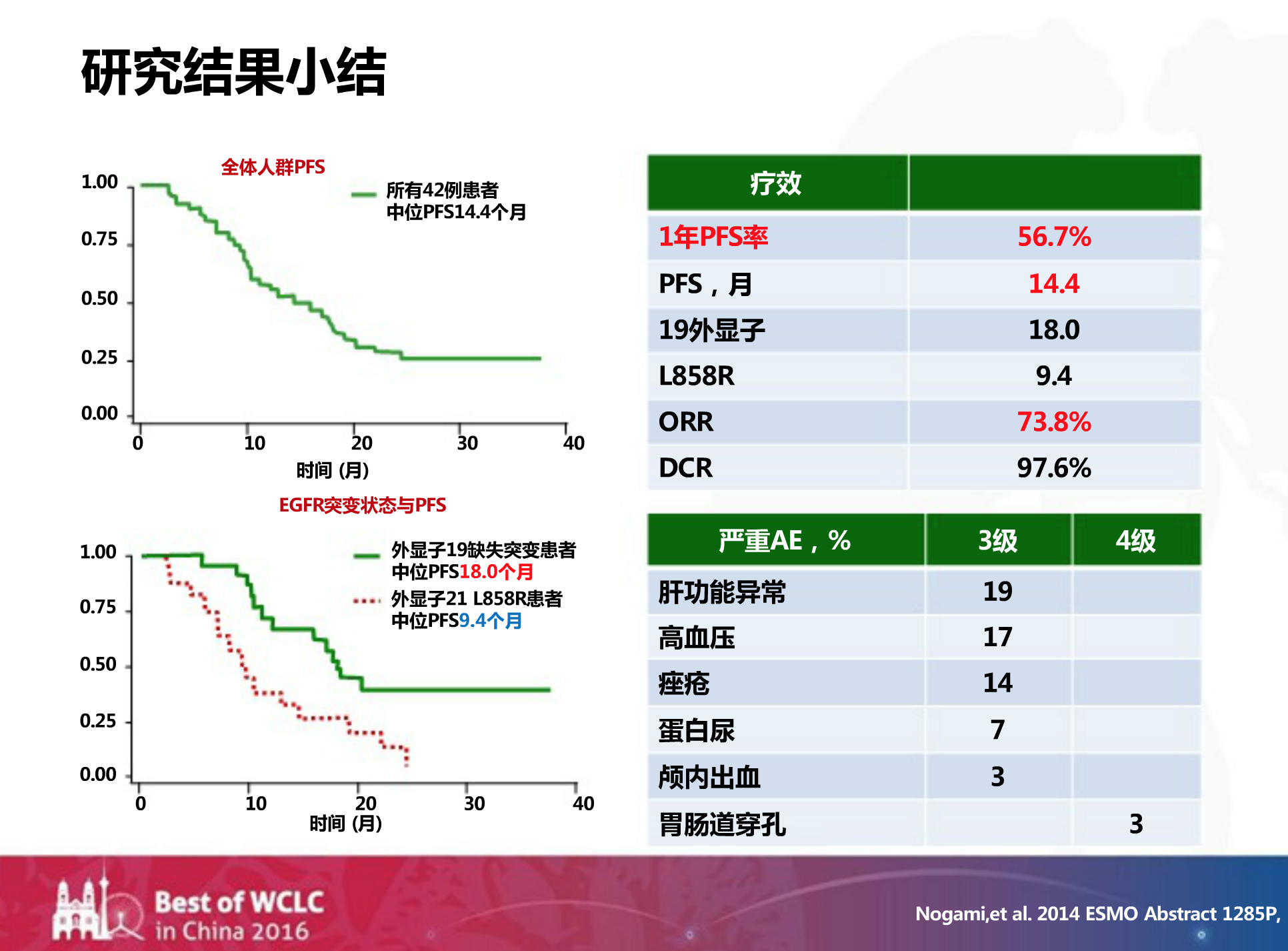
在2014年的ESMO上,也有一项名为OLCSG 1001的研究,是关于吉非替尼联合贝伐珠单抗一线治疗存在EFGR突变的NSCLC的,主要终点为一年的PFS率。

研究结果显示:整体的PFS是14.4个月,21外显子突变组的获益比较小,其PFS只有9.4个月。此外,联合治疗组的不良反应较严重,高于单药组。
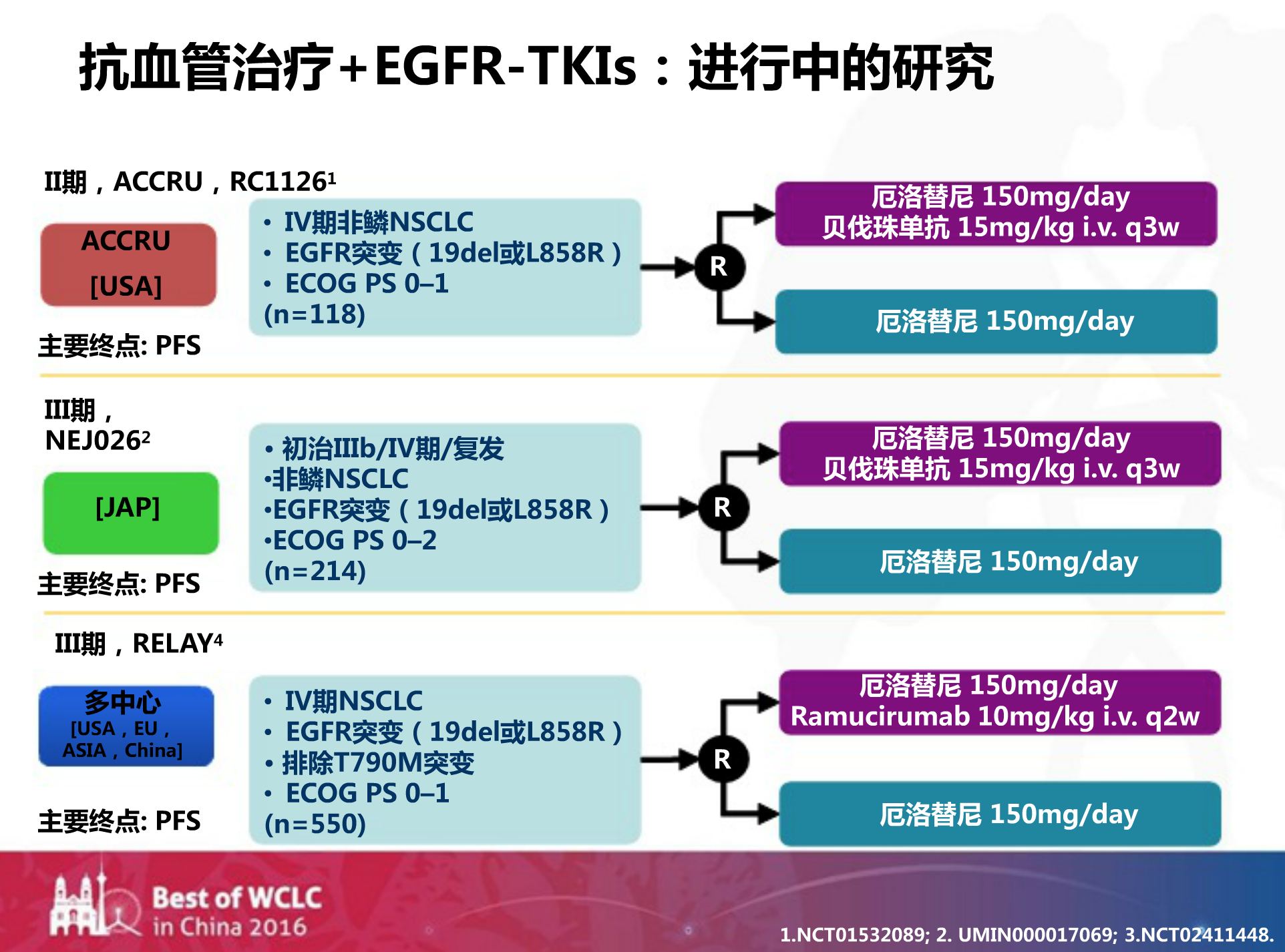
目前抗血管生成治疗联合EFGR-TKI治疗的研究仍在进行?,我们也期待更多的数据来指导临床决策。
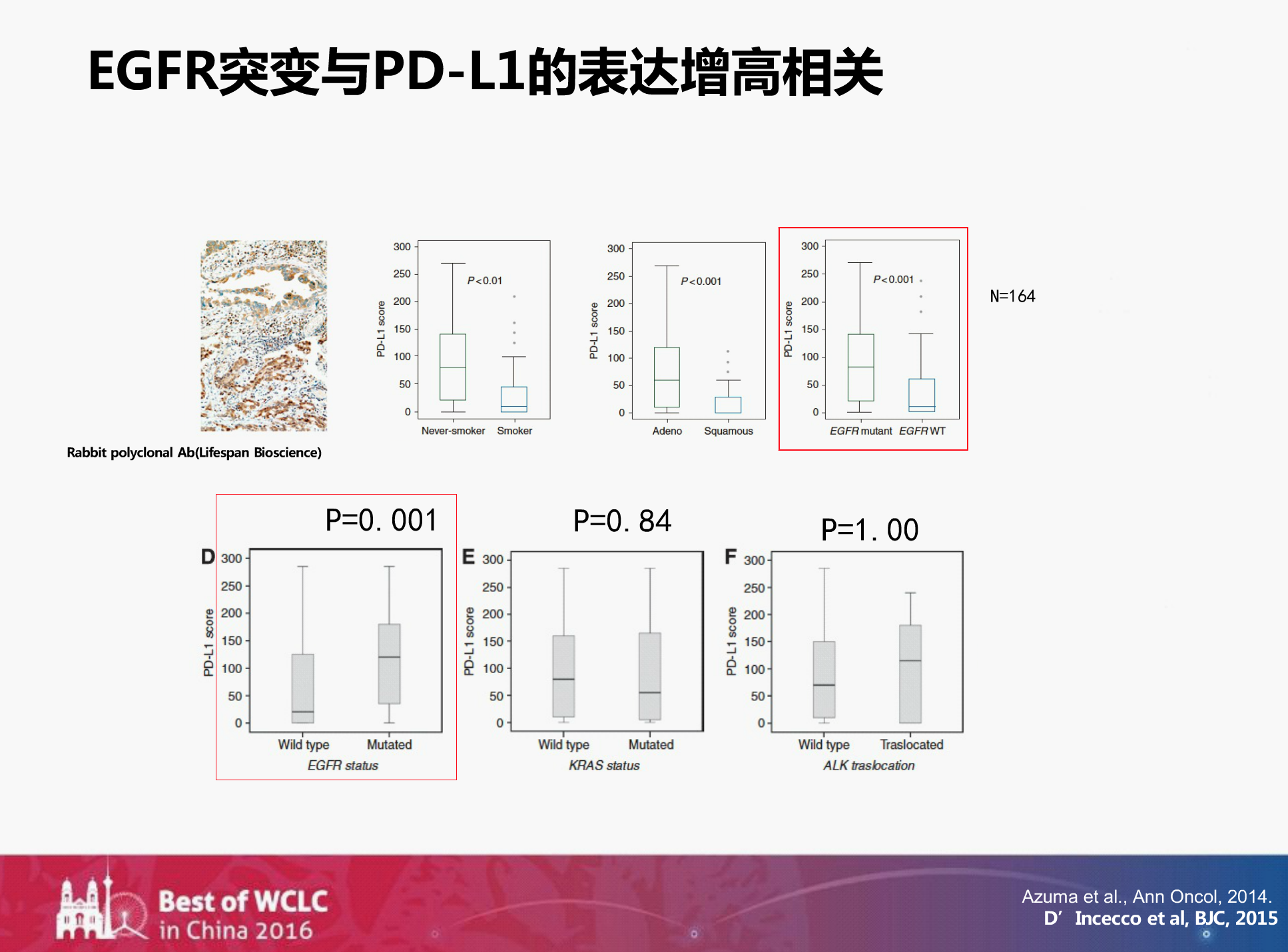
TKI除了和抗血管生成治疗联合,还可以和目前热门的免疫检查点抑制剂如PD-L1、PD-1结合。在2014年和2015年发表的两篇文献中都探讨了EFGR突变和PD-L1表达的关系。两篇文章都发现了一个问题:在EFGR突变的人群中,PD-L1的表达是增高的。
那么,是否意味着EFGR突变的人群对免疫治疗的效果更好呢?从下图?的三个研究中,我们发现,EFGR突变型患者的免疫治疗效果似乎还不如野生型患者。

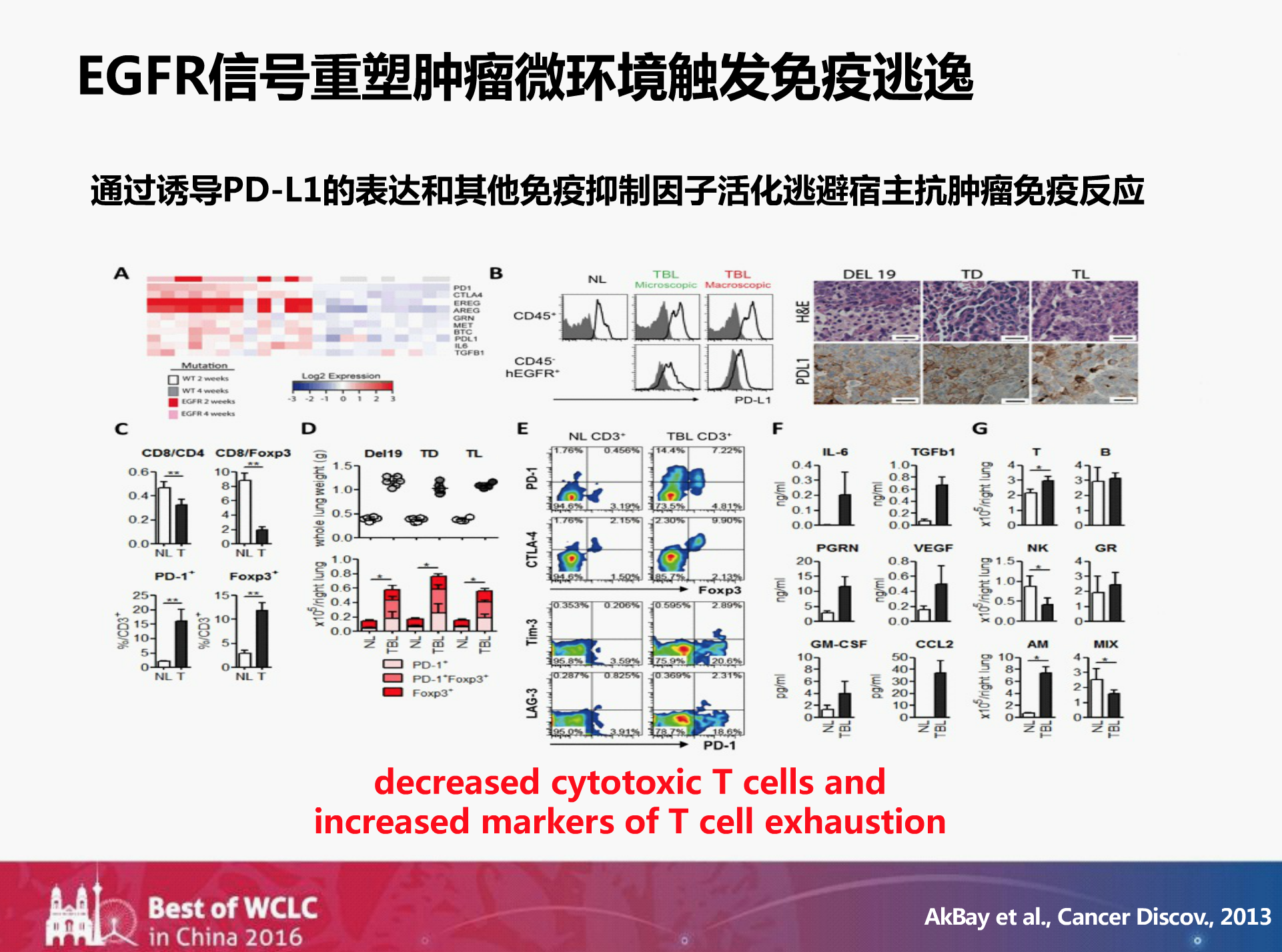
为什么会出现这个结果呢?2013年的一篇基础研究的文章给了我们启示:EGFR信号重塑肿瘤微环境,触发免疫逃逸。具体的机制为通过诱导PD-L1的表达和其他免疫抑制因子活化,来逃避宿主抗肿瘤免疫反应。
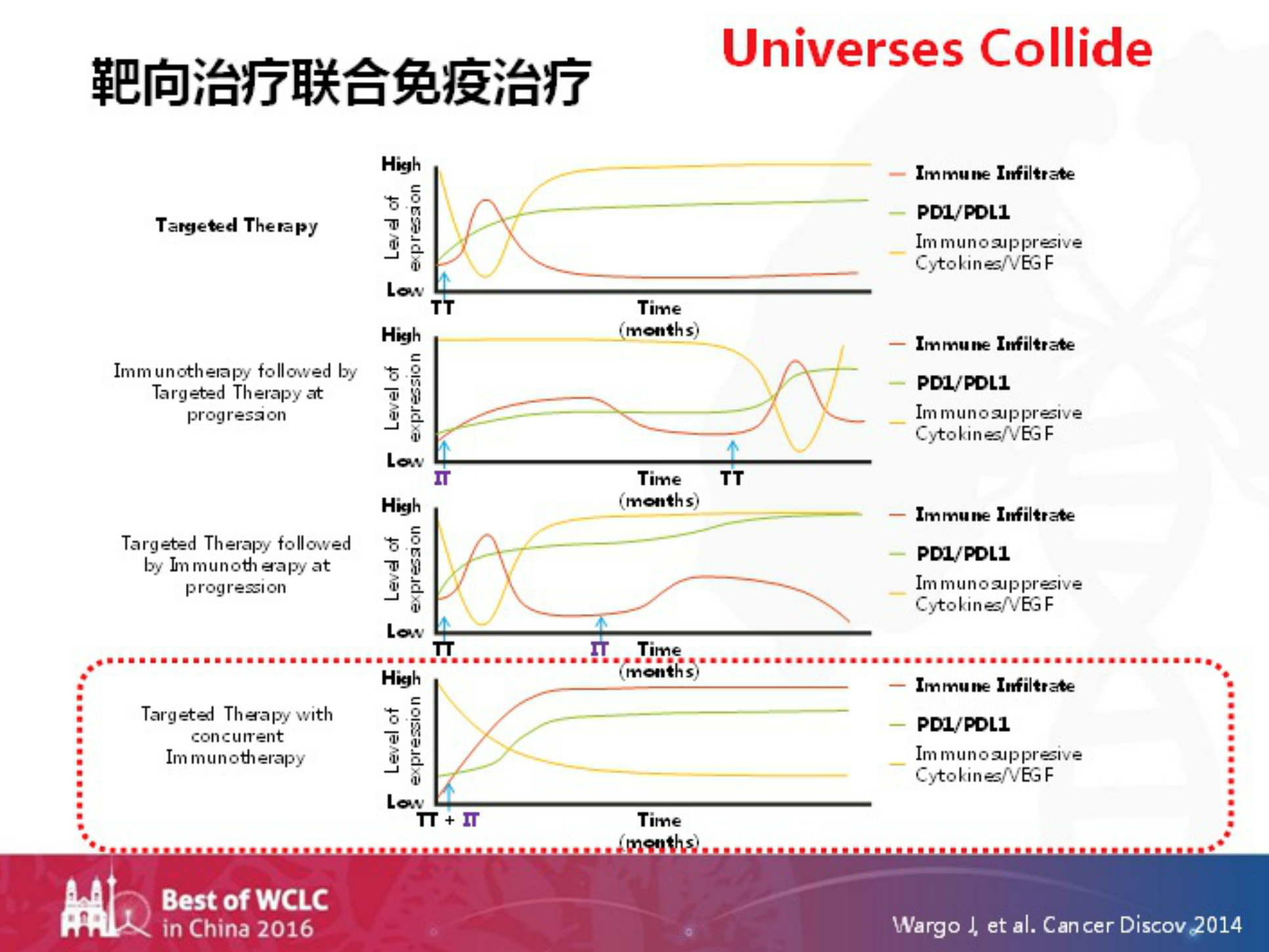
那么,有没有可能让靶向治疗联合免疫治疗,实现“宇宙碰撞”?呢?如下图?,我们看到在2014年的一篇关于黑色素瘤的研究中,设计了单独行靶向治疗、免疫治疗序贯靶向治疗、靶向治疗序贯免疫治疗以及靶向治疗和免疫治疗同步进行四组方案。结果发现,只有当靶向治疗和免疫治疗同步进行的时候,其诱导出来的微环境才更有利于免疫治疗发挥更好的作用。
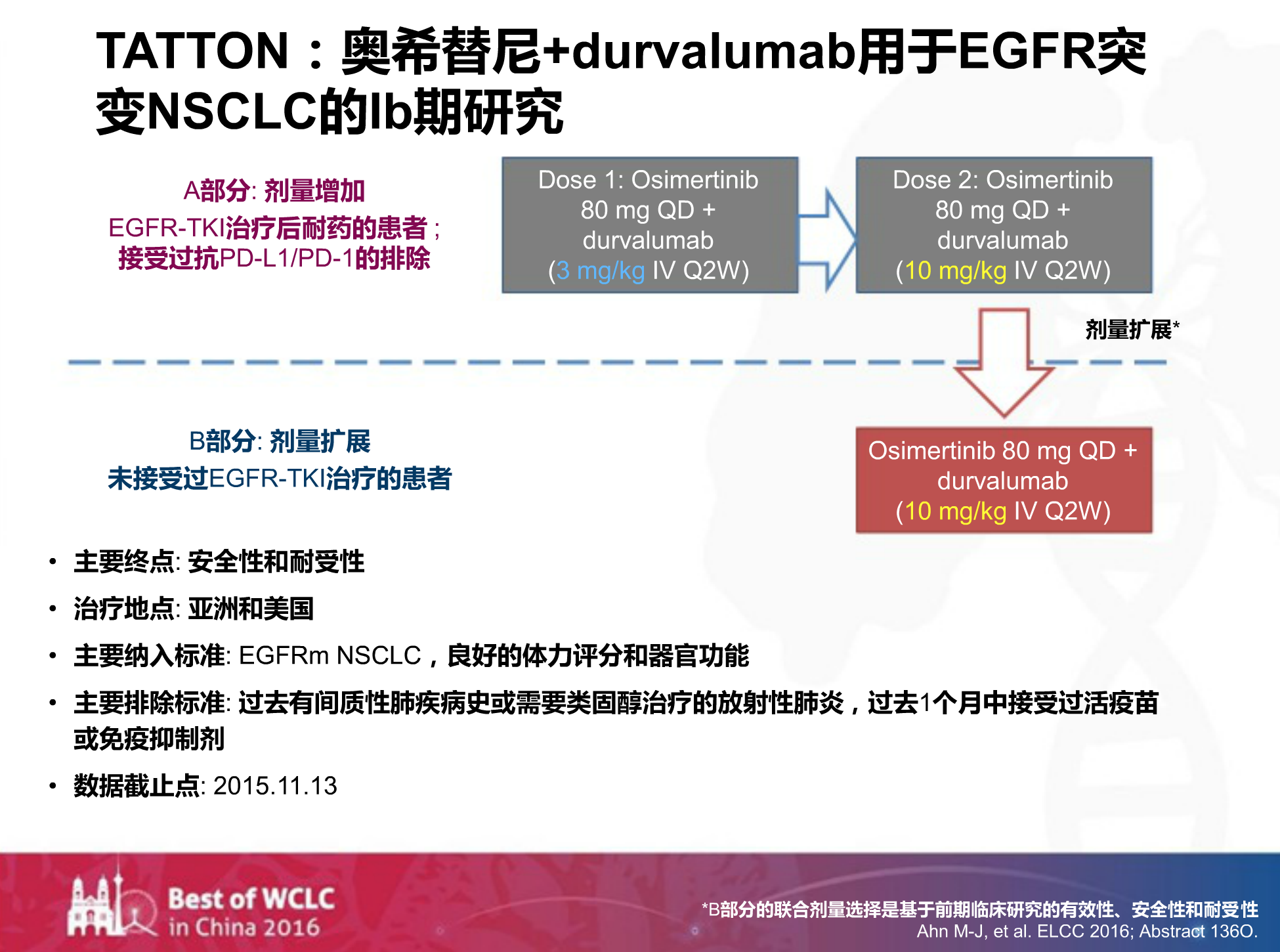
无独有偶,阿斯利康在2016年的ELCC上公布的一项奥西替尼联合PD-L1药物Durvalumab用于EFGR突变NSCLC的Ib期研究。
该研究分为A部分和B部分,A部分入组的为经过EFGR-TKI治疗耐药后的患者,采用奥西替尼80mg QD + Durvalumab (3 mg/kg IV Q2W),如果患者能够耐受的话再将Durvalumab 的剂量上调到10 mg/kg。B部分则非常大胆地选择了未接受过EGFR-TKI治疗的初治患者,同步给予A部分上调后的剂量。
我们看到,这三组患者的基线特征比较平衡。
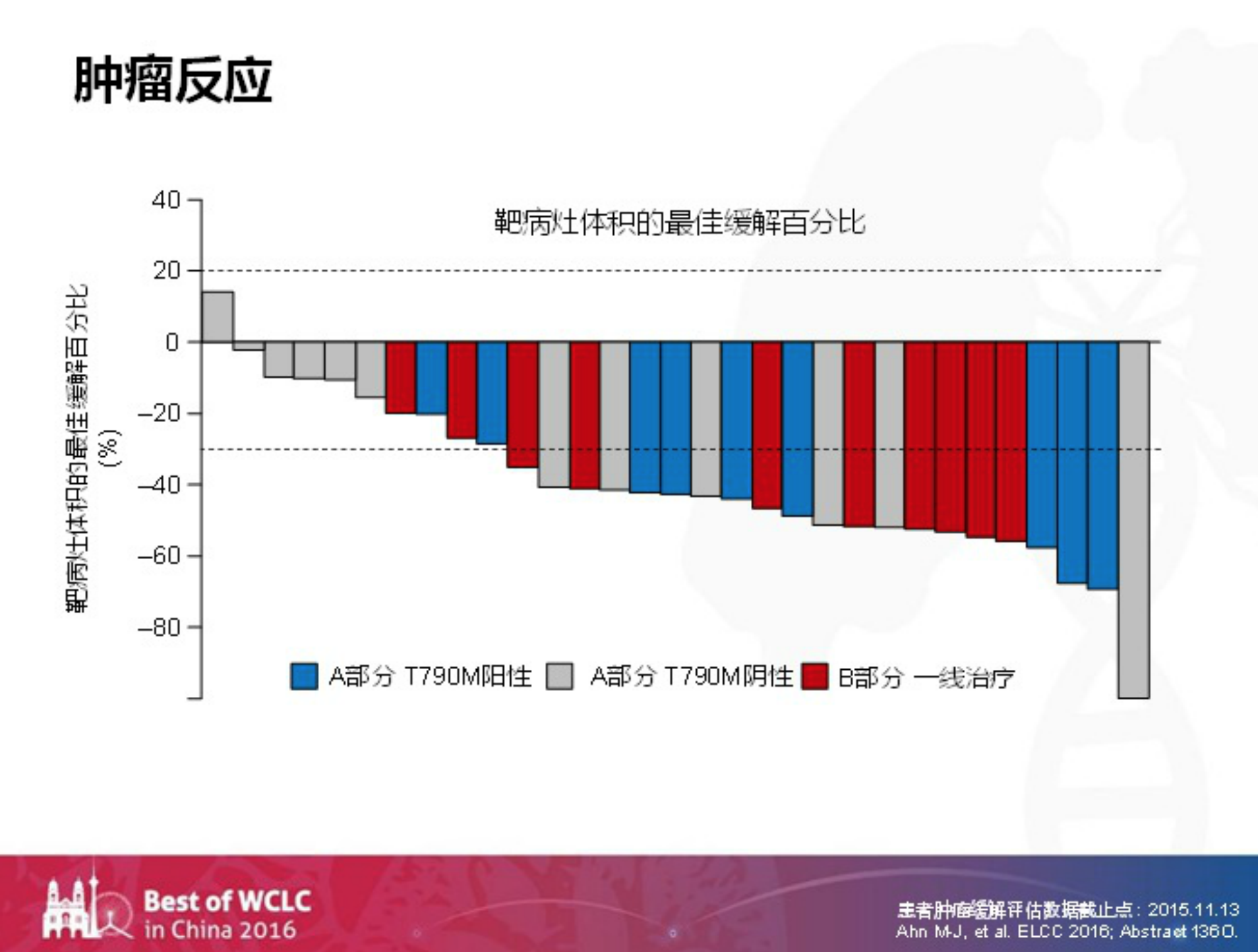
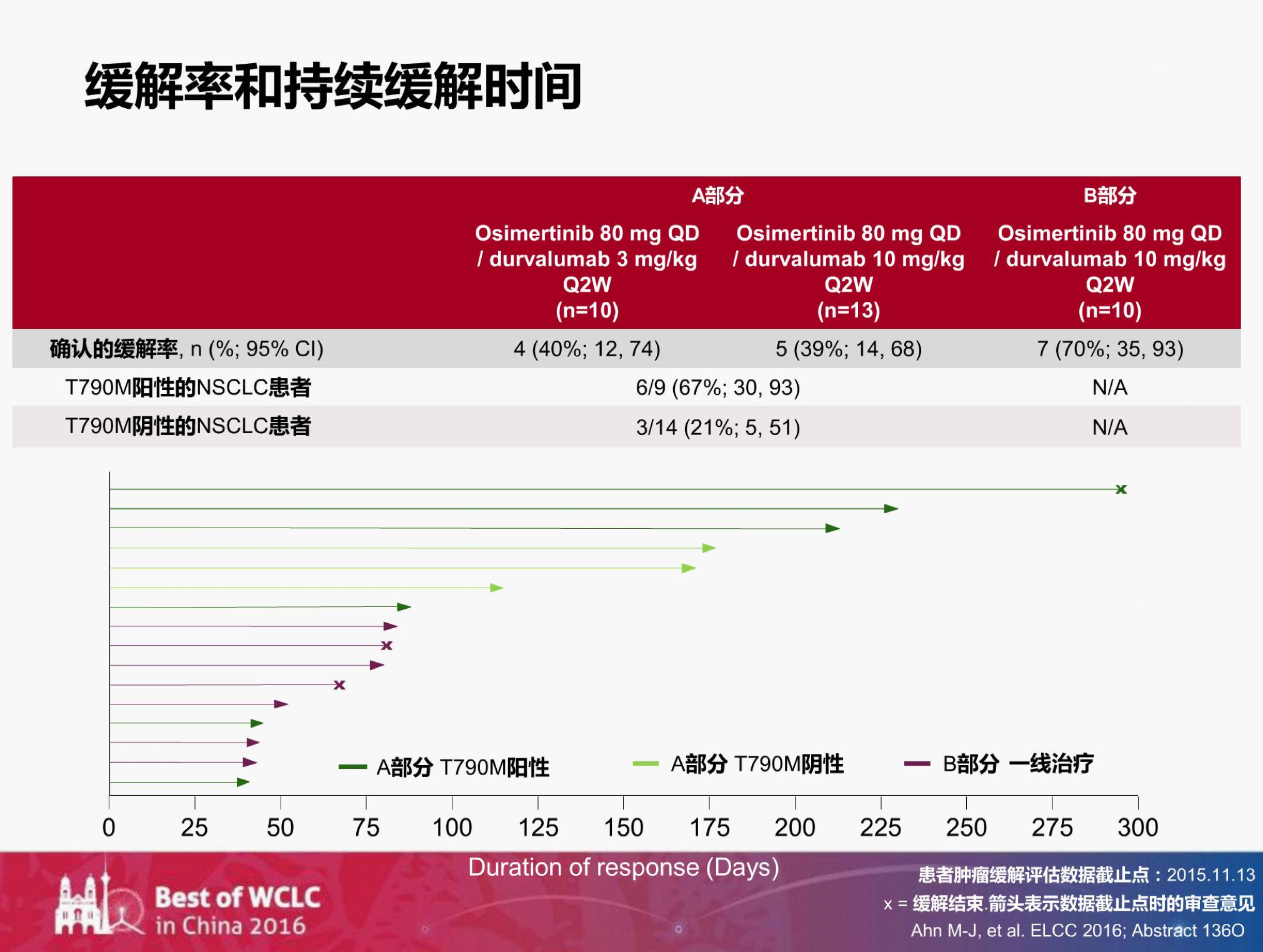
如下图?,结果显示:红色部分10个初治患者的肿瘤都有缩小,说明TKI联合PD-L1药物的治疗是能够达到比较好的疗效的。
我们再来看缓解率,B部分初治患者的缓解率有70%,远远高于A部分TKI耐药的患者(约40%)。
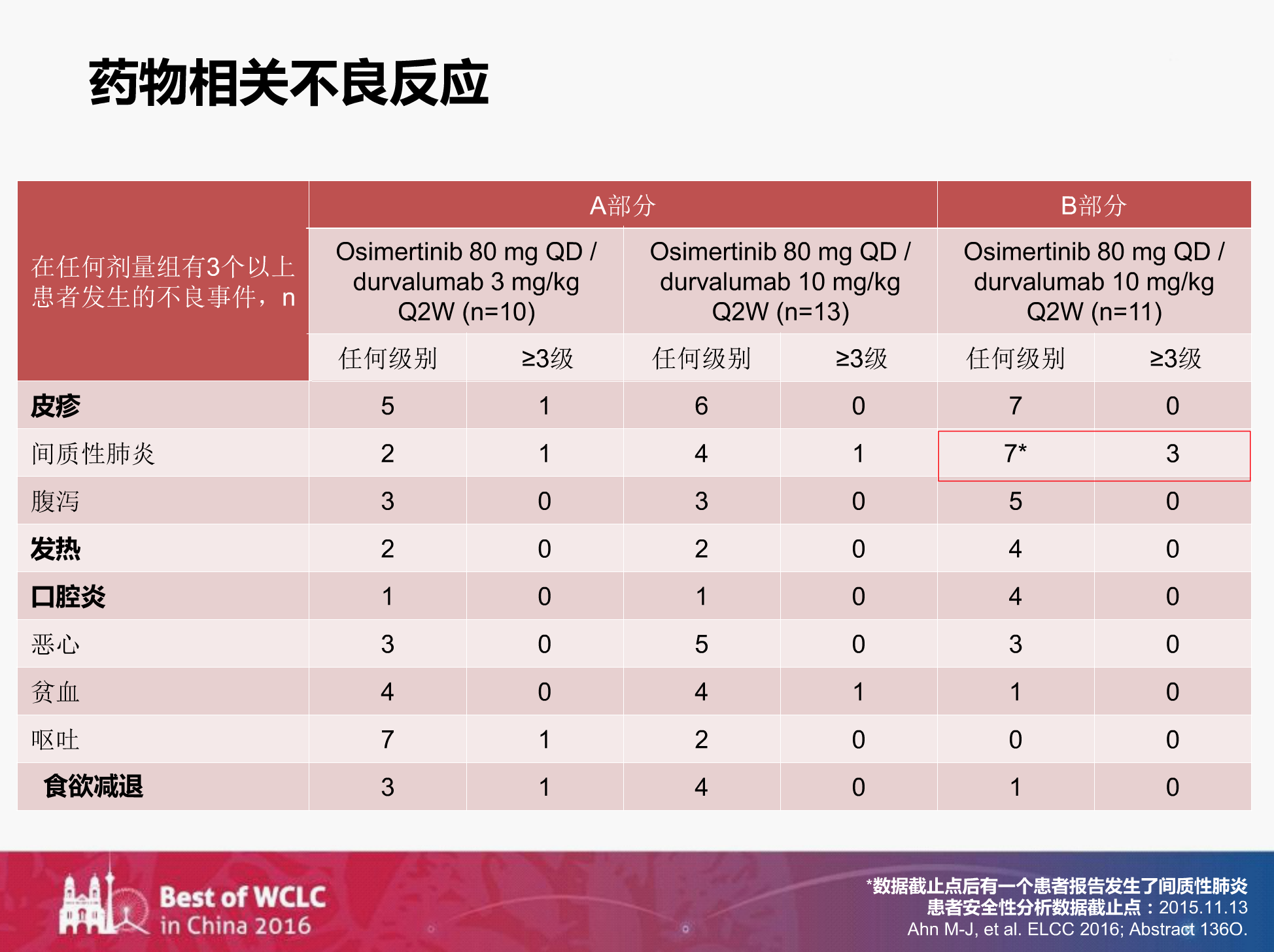
但是,B部分初治的患者发生间质性肺炎的比例非常高,11个患者中就发生了7个。而在A部分患者中只发生了2个和4个。
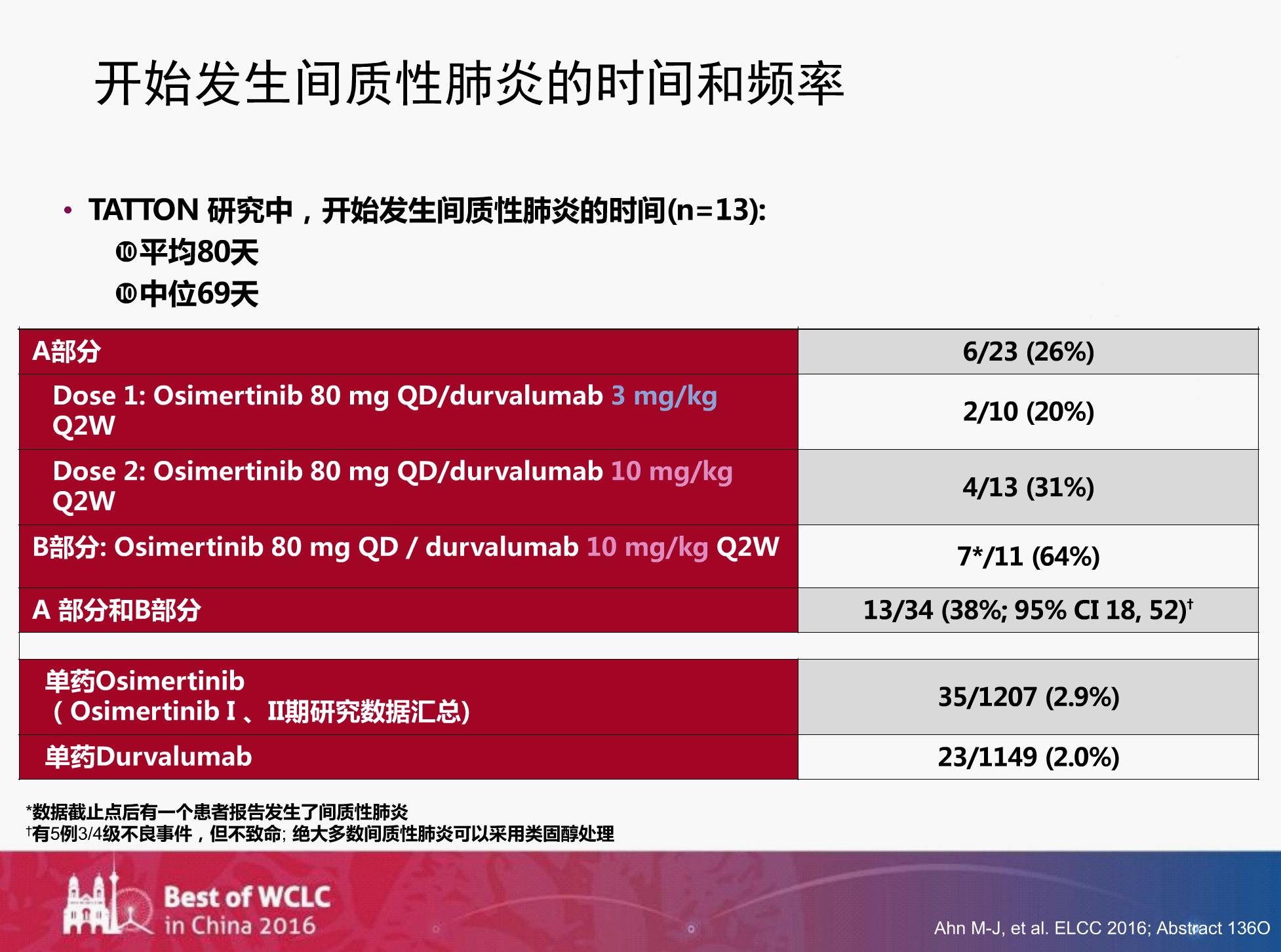
研究发现,患者发生间质性肺炎的时间平均为80天,中位为69天。
该研究得出如下?结论:
奥西替尼联合Durvalumab导致发生间质性肺炎的频率远远高于单药,该项目已经暂停患者入组,目前该不良反应发生的原因正在研究中。

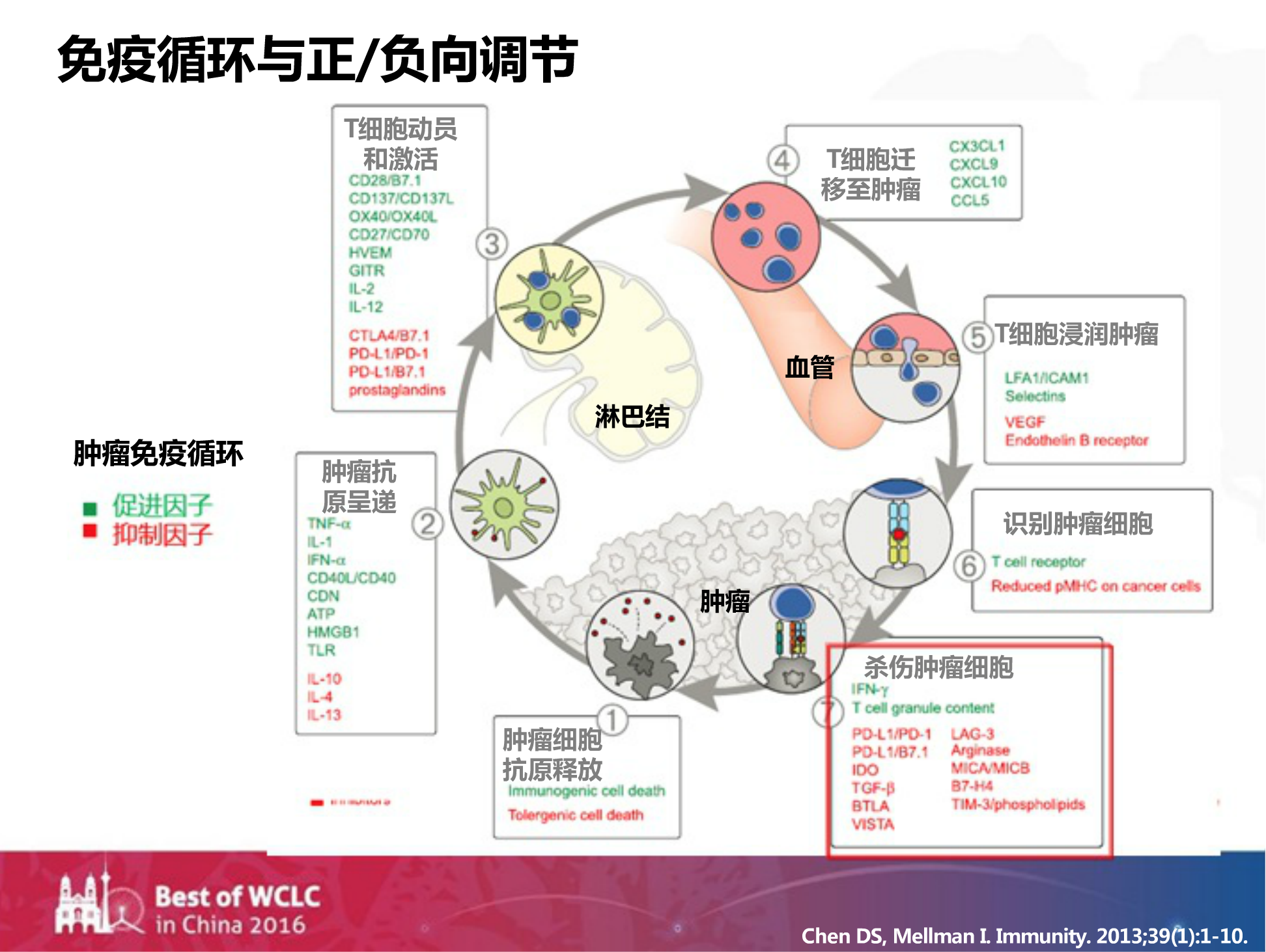
由此,我们想到了机体的免疫循环和正/负向调节。我们目前的PD-L1等药物是作用于杀伤肿瘤细胞的环节,但机体的免疫循环是非常复杂的。药物仅仅作用于某个环节,是否会破坏机体的免疫平衡,导致更多的毒副作用发生?因此,TKI联合免疫治疗导致毒性的增加,是我们未来要解决的更大问题。
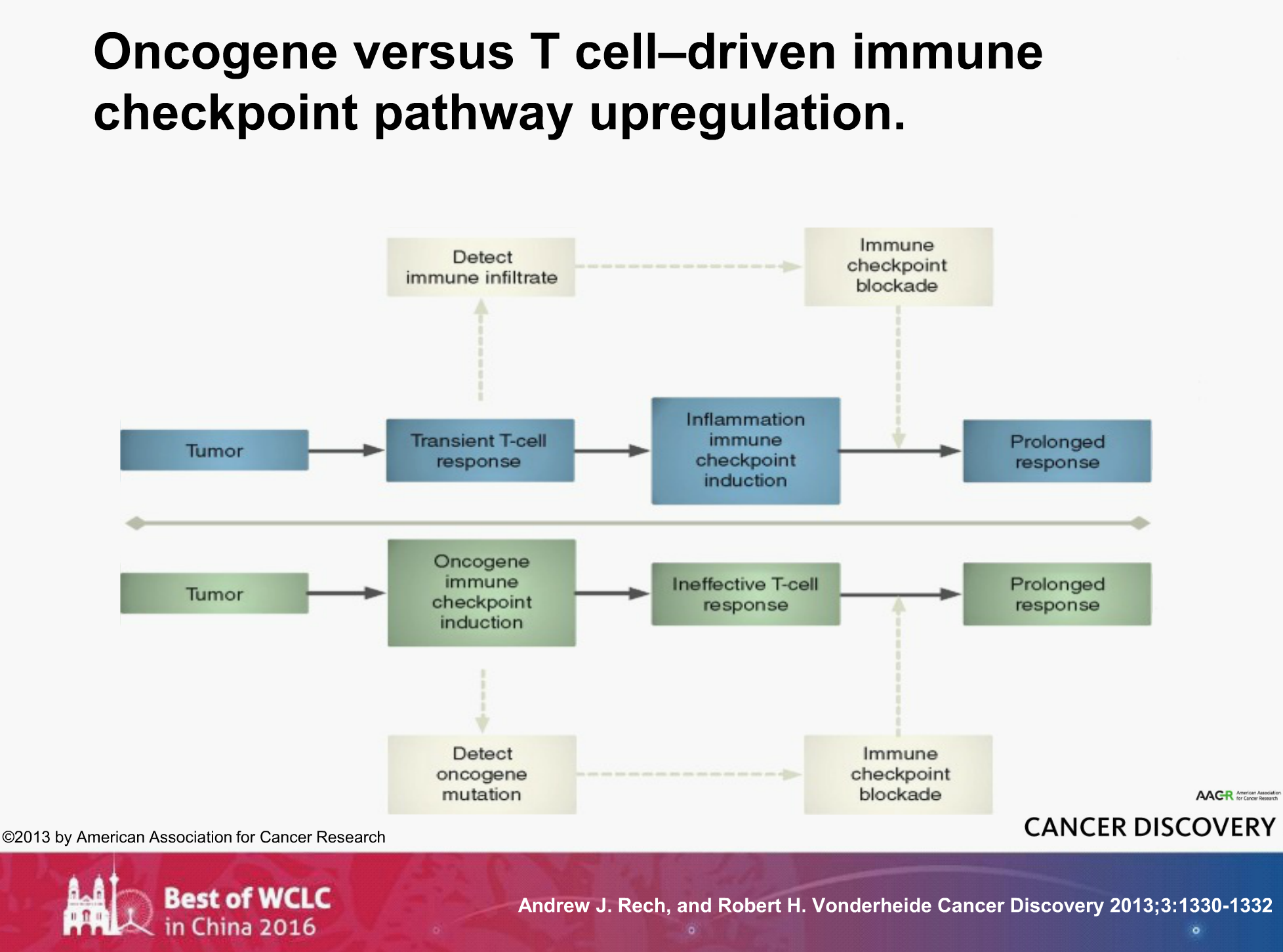
在Cancer Discovery的一篇评论中介绍道?:驱动基因突变可能诱导免疫检查点的改变,我们可以通过检测驱动基因来给予免疫检查点抑制剂的治疗。
但是对于有驱动基因突变的患者,我们要分成不同的类型。目前我们知道,EFGR和ALK的突变是可以诱导PD-L1表达上调的,但是KRAS突变并不能诱导PD-L1的表达。
因此,有专家认为,可能并不是驱动基因诱导了PD-L1的表达,而是免疫浸润的淋巴细胞直接诱导了PD-L1的表达。那么对于这样一种情况,我们可以通过检测免疫浸润来给予免疫检查点抑制剂,最终使病人获益。
王教授最后对本次演讲做了总结:
一 、在TKI联合化疗或抗血管生成治疗的研究中,患者能够延缓耐药的时间,PFS可达到16-18个月,但是否能够延长OS仍然未知。
二、TKI联合免疫治疗的初步疗效较好,但毒性增加的机制未明。
三、联合治疗还面临如下实际问题:
何种人群适用于联合治疗?
TKI联合治疗耐药后怎么办?能否沿用TKI单药耐药后的治疗方案?
如何应对更加复杂的不良事件?
联合治疗必然给患者带来更大的经济负担,如何平衡经济支出和临床获益?

【HapOnco-WCLC 2016】顶级医生解读中国肺癌最新诊疗策略(一)
【HapOnco-WCLC 2016】靶向治疗对于肺癌患者而言,有可能是Now Or Never的差别(二)
【HapOnco-WCLC 2016】一代和二代EGFR-TKI谁与争锋?三代TKI谁在一枝独秀?(三)
通过基因检测确定患者的突变状态,对作出治疗决策至关重要。海普洛斯的血液检测产品可以无创实时准确地为患者明确基因突变状态,辅助医生及时作出治疗方案的决策。
本文仅供医学药学专业人士阅读





















 X
X