有位患友这么说,“像是登险峰,大家都知道很难,但是能爬到山顶你就胜利了!”
在抗癌这场登山中,医生就像是指路人,他们可以在重要的分叉路帮我们找到最安全和快捷的路线。
但医生不能代替患者登顶,甚至也不能保证路线一定正确。尤其当前面的道路不清,或很少人走过时,医生和我们一样迷茫。
所以永远有些做研究的“引路人”和敢于尝试的“探路者”们,他们不断地尝试,试图帮助我们找到下一步的答案。
肺癌三代靶向药奥希替尼(泰瑞沙)耐药后怎么办?很多患者都在焦急期盼前方有人指一条明路。以下将要呈现的20种方案是一些研究者和患者们在奥希替尼耐药之路上的 公开探索,有些仅仅是个人的尝试经验,甚至个别还只是体外细胞和动物实验。
1.务必重视再次活检。
奥希替尼的耐药机制有很多种,没有一个绝对占多数的机制,因此没办法去参考别人。如果根据自己的情况选择治疗方案,活检是获得更多信息的有效手段。如果可能,组织活检和血液活检一起做可能帮助获得更多信息。
2. 免疫治疗仍有机会。
经历多线靶向治疗、化疗后,肿瘤组织的PD-L1表达可能会提高, PD-L1高表达患者仍可能从免疫治疗中继续获益。
3. 多靶点靶向药物作为选择之一。
例如,安罗替尼(已获批的国产抗血管生成抑制剂)作为晚期肺癌三线治疗方案的获批,没有具体要求患者此前的基因突变状态以及此前的治疗方式,按照适应症来说二线奥希替尼治疗耐药后,作为三线治疗选择是在适应症范围内。
4. 化疗永远是选择之一。
当疾病快速进展或症状明显时,化疗可控制病情快速进展,至少能为尝试其他试验性治疗方案争取时间。
2015年11月奥希替尼在美国获批上市,2017年3月国内获批上市,几年之间,虽然对耐药之后的具体方案还未定,但研究者们对耐药后的肿瘤细胞的逃脱路线了解不少,并在一些路线上做了测试。
目前,肿瘤细胞针对奥希替尼“进化”出的路线,主要分两类:
● 原有的EGFR基因发生新的突变,导致奥希替尼不再有效,这种叫做EGFR依赖性耐药;
● 肿瘤出现新的增长途径,包括产生其它新的突变(如HER2/BRAF)、新的生长通路等,称为EGFR非依赖性耐药。
EGFR变异类型包括:
① EGFR基因突变(如C797S)
② EGFR基因扩增或缺失
1. C797S突变
C797S突变是最常观察到的继发性EGFR突变,也叫做EGFR C797S。这个位点的突变可能直接导致奥希替尼药物无法与EGFR突变结合,从而出现耐药,以下介绍4种应对方案。
应对:
a. 奥希替尼+吉非替尼(或其它一代靶向药物)
研究发现,通常EGFR C797S突变对一代靶向药物敏感,奥希替尼耐药后可能出现T790M突变合并C797S突变。

如右上放大镜里的橘黄色
但问题来了,C797S突变和T790M的突变有两种形态,一种为顺式(cis),一种为反式(trans)。什么意思呢?
● 顺式:一条正常的染色体上出现EGFR突变,然后在同一条染色体上继续出现EGFR T790M突变,然后还是同一条染色体上又出现了EGFR C797S突变,一条路顺下来。
● 反式:一条正常的染色体上出现EGFR突变,然后在同一条染色体上继续出现EGFR T790M突变,但随后却在同一对的另一条染色体上出现C797S突变,此为反式。
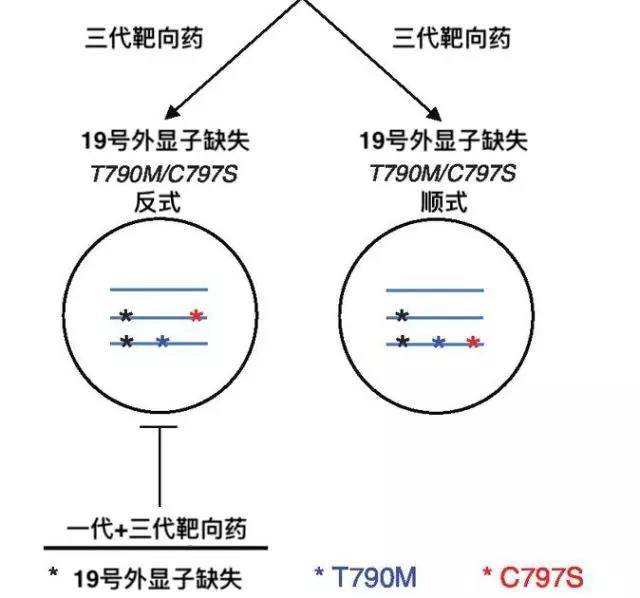
如果突变为反式,则奥希替尼联合一代靶向药方案是一种选择。但如果两个突变为顺式突变,那患者可能对一、二、三代靶向药物都已经耐药了。
首个全球采用这种疗法的病例来自澳大利亚的一份医生报告:
1名奥希替尼耐药患者,通过液体DNA活检发现有T790M和C797S反式突变,随即患者接受了奥希替尼+吉非替尼联合治疗,治疗2周内患者的临床情况明显缓解,且血浆内C797S突变的水平也明显下降。
但患者血液中Exon19缺失突变和T790M水平却持续上升,最终患者在联合治疗6周后疾病进展过世,治疗过程中,并未观察到患者的不良反应问题。在国内也有一些患友采用这种方法应对奥细腻耐药后问题,但具体的疗效没有临床报道。
b. EAI045+西妥昔单抗(爱必妥)
2017年著名杂志《Nature》发表研究显示:在动物试验研究中,观察到EAI045+西妥昔单抗方案针对EGFR L858R,T790M及C797S三突变的动物模型具有抗肿瘤疗效,具体在人体的临床效果还有待进一步验证。
c. Brigatinib(Alunbrig)+西妥昔单抗/ 帕尼单抗(维克替比)
2017年,《Nature Communication》杂志发表研究显示:肺癌ALK靶向药Brigatinib无论在体外细胞试验还是动物模型中,对EGFR三突变(Exon19del/T790M/C797S)都具有抑制效果,并在联合EGFR抑制剂西妥昔单抗或帕尼单抗后,抑制肿瘤活性增强,成为临床可尝试的一个治疗方案。不过目前尚无公开报道临床应用案例。
d. 其它EGFR基因突变
其他目前发现的奥希替尼后出现的耐药EGFR突变还有如G796D/S/R,G796S/R,L792F/Y/H,C797S/G、L781Q等
应对:
目前尚无针对性的靶向药物应对方法。
2. EGFR扩增及缺失
在一些奥希替尼耐药患者中,同样观察到EGFR exon19缺失突变及野生型的基因扩增,发生率4%-35%不等,同时也有研究发现奥希替尼耐药的肿瘤细胞EGFR蛋白低表达状态(缺失)。
应对:
a. Rociletinib(三代靶向药)+爱必妥或阿法替尼(吉泰瑞)+爱必妥
针对EGFR扩增情况,有报道认为Rociletinib(三代靶向药)+爱必妥或阿法替尼(吉泰瑞)+爱必妥可能对EGFR基因野生型扩增导致的耐药有效。
b. Navitoclax (ABT-263)
Navitoclax (ABT-263)是BCL-2家族的抑制剂,在体外细胞试验和动物试验内研究发现,针对奥希替尼类药物逐渐不敏感的肿瘤细胞,该药具有能增强这些抑制剂活性的作用。但目前尚无临床数据报道。目前正有一项Ib期临床试验,采用Navitoclax联合奥希替尼治疗EGFR靶向药物耐药的EGFR突变非小细胞肺癌(NCT02520778)。
肿瘤发生了EGFR之外的其它变化
非EGFR依赖性耐药是指EGFR基因以外,出现新的基因突变或旁路激活等改变。比如各种各样的旁路耐药机制(bypass resistance mechanisms),如HER-2、MET等。
1. ERBB2(HER-2)扩增:
最常见的旁路机制是ERBB2扩增,约占各种靶向药物耐药的10%~15%。
应对:
T-DM1(Trastuzumab emtansine ,Kadcyla)+奥希替尼
T-DM1是获批用于乳腺癌的抗耦联物药物,目前仅仅在动物模型中显示,T-DM1联合奥希替尼可能针对HER2扩增所致的奥希替尼耐药有效。但尚无有效的临床证据证实在伴发ERBB2扩增的人群中加用HER-2靶向药能改善疗效。
2. MET扩增:
MET扩增见于不足5%的耐药患者。MET扩增是目前肺癌靶向药物研究比较热门的靶点,迄今为止,尚无特异性针对MET扩增耐药的针对性靶向药物上市,但已有少数个案和研究报道发现,在此类人群中,联用EGFR TKI和MET抑制剂可以获得更好的治疗效果,以下有5种尝试。
应对:
a. 奥希替尼+克唑替尼
该组合疗法有1例公开报道患者案例,患者是1名41岁男性患者,最初诊断为IV期非小细胞肺癌(腺癌),发现时为右肺肿块伴胸腔内外淋巴结转移。
患者的治疗经历,经历6种治疗方案(包括:厄洛替尼*20个月,Rociletinib*13个月,卡铂+培美曲塞*7个月,厄洛替尼+培美曲塞*1周期,奥希替尼*6个月,奥希替尼+克唑替尼*6个月,整个过程约52个月,结局未知)
在报道的最后一次治疗中,经过网膜活检,基因检测发现EGFR基因 L858R和K806I依然存在,但T790M突变消失,MET扩增明显。患者开始接受奥希替尼+克唑替尼联合治疗,患者的腹水和腹腔转移情况一度消失,治疗4个月时,一度出现肿瘤标志物CEA上市,经过克唑替尼加量(每日2次,每次200mg加至每次250mg),6个月后,全身和脑部的肿瘤病灶维持稳定。
b. 奥希替尼+ Savolitinib (Volitinib,沃利替尼)
Savolitinib是和黄医药与阿斯利康合作开发的首创c-MET抑制剂。
奥希替尼+ Savolitinib联合方案在2017年世界肺癌大会(18th WCLC)首次报道,其中有1组数据,共有30名患者,这些患者都接受过针对T790M突变(三代靶向药物,包括奥希替尼)的治疗,患者都出现MET扩增。
这些患者在接受奥希替尼+ Savolitinib联合治疗后,中心评审评估了25名患者的疗效,肿瘤整体缓解率(ORR)为28%(当地评估30名患者,ORR 33%),有7名患者疾病稳定(疾病控制率DCR可达80%),缓解维持时间在2.2个月-9.6个月不等。
这可能是目前能找到的针对MET扩增型耐药治疗的患者数量最大的临床研究。
c. 奥希替尼+SGX523
SGX523也是一种c-MET抑制剂,动物模型中显示该联合疗法能控制肿瘤生长。
d. 克唑替尼
有1例病案报道。患者为1名73岁女性,诊断为IV期非小细胞肺癌(腺癌),基因检测为19号外显子缺失突变。
患者在厄洛替尼治疗及化疗治疗进展后,接受了活检发现T790M突变,加入奥希替尼的临床试验(AURA2研究),获得部分缓解(PR),维持9个月。
患者接受再次活检发现新出现MET扩增,且T790M突变在奥希替尼治疗后明显减少。随及患者接受单药克唑替尼治疗,在开始14天内,患者气短等症状明显缓解,1个月后检查肿瘤稳定,但在治疗6周后患者因为严重下肢水肿和乏力暂停用药。
在症状缓解后,因奥希替尼那时在美国上市,她开始接受奥希替尼(每天40mg)+克唑替尼(每天1次250mg)治疗,但该组合仅治疗1周,患者症状持续恶化,随后拒绝任何治疗后过世。
e. Capmatinib+阿法替尼
Capmatinib是一种c-MET抑制剂,动物模型中显示该联合疗(同时针对c-MET和HER2)能控制肿瘤生长。
3. 其它耐药机制的研究:
旁路机制,包括BRAF、PIK3CA、KRAS、PTEN丢失、NF-1丢失、CRKL扩增;其余基因表达上调,包括IGF1R、FGFR、肝细胞生长因子、MET配体等。
应对:
a. 奥希替尼+Encorafenib(BRAF抑制剂)
Encorafenib是一款还未上市的BRAF抑制剂,目前已上市的BRAF抑制剂包括达拉非尼(Tafinlar)和维莫非尼(佐博伏)。
关于该组合方案,有1例公开发表的来自台湾的临床报道,患者是42岁男性,在2010年针对为IV期非小细胞肺癌(腺癌),由于多发骨转移,接受了局部姑息性放疗,基因检测发现21号外显子突变(L858R突变)。
患者先后接受了培美曲塞+顺铂,厄洛替尼,吉非替尼,吉西他滨4种治疗,直至2014年,疾病进展,再次活检发现19号外显子和T790M突变,随机加入奥希替尼临床试验,肿瘤部分缓解(PR),疾病维持13个月。
再次活检发现,肿瘤的突变变成了“19号外显子+T790M+BRAF V600E”三突变,但可惜患者在疾病进展后1个月过世,未接受BRAF抑制剂治疗。只是取出患者胸腔积液里的细胞,进行体外培养试验中发现,奥希替尼+Encorafenib针对这类耐药细胞具有抑制作用。
尽管许多旁路通路的激活尚无针对有效的治疗方案,但是其并常常以一种伴随突变的形式伴随着T790M出现,进而可能影响着Osimertinib的疗效,通常的选择方案都是奥希替尼联合使用例如:
•针对KRAS突变采用奥希替尼+曲美替尼(Trametinib)或奥希替尼+司美替尼(Selumetinib)等。 •针对SFK/FAK通路激活,采用奥希替尼联合SFK抑制剂(PP2, 达沙替尼/dasatinib, 伯舒替尼/bosutinib 及saracatinib)或FAK抑制剂(PF573228); •针对Hedgedog通路活化,采用奥希替尼+Sonidegib(商品名:Odomzo)方案。 •针对EPHA2表达耐药,ALW-II-41-27在体外细胞试验中证实有一定抑制效果。
但目前以上方案都尚处于体外细胞试验阶段或动物模型研究阶段,临床具体用在患者身上的疗效还没有报道。
今年即将在6月初举行的美国临床肿瘤学会(ASCO)年会上,青岛中心医院的医生团队报道了11名奥希替尼治疗进展后的患者的突变及治疗情况。
他们发现,在奥希替尼治疗耐药后,所有11名患者均保留原有EGFR 19或L858R突变,还有8名患者保留原T790M突变,6名患者出现EGFR 19del或L858R突变+T790M+C797S 和/或 C797G三突变。
治疗情况:
● 3名T790M突变丢失的患者重新使用吉非替尼,1名维持稳定3个月,2名刚开始治疗,效果未知; ● 1名患者在EGFR 19 del+T790M+c797G突变基础上还发现EML4-ALK基因融合,服用了1个月克唑替尼治疗无效进展,改为Brigatinib+西妥昔单抗治疗,2个月后肿瘤部分缓解。 ● 2名患者因肿瘤进展过世。 ● 还有5名患者后续接受化疗或者支持治疗,仍在随访中。
是的,没错。在奥希替尼治疗后,肿瘤细胞出现小细胞肺癌转化耐药在临床的报道中也不算少见,其他一代、二代靶向药物中也可能出现这类耐药。
在这些细胞中,出现RB活性丢失、TP53活性丢失等小细胞肺癌的特征性改变,尽管这些细胞仍保留有原始的EGFR突变,但表达水平却出现了不同程度的下降,这暗示采用针对EGFR突变的治疗可能已经不会起效了。通常的治疗方案是采用针对小细胞肺癌的化疗方案如依托泊苷或含铂的化疗。
应对:
依托泊苷+卡铂
针对奥希替尼耐药后的小细胞转化,韩国和国内一共3名患者的临床报道都不约而同地为患者进行了卡铂+依托泊甘的化疗方案,且病情都得到一定控制。3名患者情况分别如下:
● 案例1: 57岁女性患者,初诊为IVA期非小细胞肺癌(腺癌),确诊携带21号外显子(L858R)突变,先后接受厄洛替尼*12个月,因活检发现T790M突变,接受奥希替尼*14个月治疗。
由于疾病快速进展,重新进行肺部活检,发现肿瘤细胞出现小细胞肺癌转化,并且有EGFR 21号外显子突变和EGFR基因扩增,T790M突变消失。
随及患者改用卡铂+依托泊苷化疗,2周期后患者的肿瘤明显缩小(PR),症状也明显缓解,后续结局未知。
● 案例2: 58岁女性患者,肺癌切除术后2年复发转移。一开始患者基因检测显示EGFR突变为野生型,也就是没有突变。但仍先后接受阿法替尼*9个月,厄洛替尼*24个月治疗,再次活检发现有19号外显子+T790M突变,遂加入临床试验接受奥希替尼治疗,维持18个月。
进展后发现肿瘤细胞出现小细胞肺癌转化,EGFR 19号外显子突变仍然存在,但T790M突变消失。患者接受卡铂+依托泊苷化疗后肿瘤部分缓解(PR),后续结局未知。
● 案例3 很神奇的中国患者。52岁女性,最初在2014年5月发现右上肺50px大小肿块,随机接受肺叶切除术和淋巴结清扫,术后确诊为IIIA期肺癌(腺癌),患者在术后接受2个周期的吉西他滨+顺铂方案后,发现肺内多发结节,怀疑复发。
2014年9月,患者开始厄洛替尼治疗,肿瘤部分缓解(PR),维持11个月。2015年8月,疾病进展,由于无法直接活检,进行血液的液体ctDNA检测,并未发现19号外显子或T790M突变,患者接受了2个周期培美曲塞+奈达铂化疗,疾病很快进展,然后换成多西他赛+贝伐单抗,仍然进展。
2015年12月,患者开始尝试奥希替尼,结果症状明显患者,肿瘤明显缩小(PR),疗效维持约5个月。
2016年5月,因为发现肝脏新发转移病灶,活检发现出现小细胞肺癌转化,基因检测发现19号外显子突变,无T790M突变。患者随及在原来奥希替尼基础上加用卡铂+依托泊苷化疗,2个周期治疗后,显示肝部病灶略缩小,但是还是未达到部分缓解(PR),至文章发表时患者仍在随访,结局未知。
○ 同样是在即将召开的ASCO年会上,美国团队医生报道了50名发生小细胞肺癌转化的EGFR突变非小细胞肺癌患者。其中,有9名患者是在接受奥希替尼治疗后发生小细胞肺癌转化。
在这50名患者中,最常用的治疗方案为铂类+依托泊苷化疗(35名),报道的临床缓解率(cRR)51%,中位肿瘤无进展生存时间(PFS)为2.8个月。20名患者还在发生小细胞肺癌转化后接受过紫杉醇类化疗方案(可能在铂类化疗后),临床缓解率为(cRR)50%,中位肿瘤无进展生存时间(PFS)为3.1个月,而有15名患者接受免疫治疗(其中6名接受Nivolumab+Ipilimumab联合免疫),没有1名患者肿瘤缓解。患者从出现小细胞肺癌转化开始,中位的生存时间(OS)为10.9个月(95% CI: 7.3-13.8个月)。
免疫治疗近些年可谓肺癌治疗“万金油”级别的王牌, 但前期的研究显示,它对有驱动突变(EGFR/ALK)的肺癌患者却可能不适用,接受免疫治疗的效果实际可能不如化疗。
但是,研究者和患者们从未放弃过尝试,在奥希替尼耐药后进行免疫治疗,不管是单用还是联化疗,联靶向,都有相关临床试验,也已经有部分临床数据披露。
应对:
a. 奥希替尼+Durvalumab(Imfinzi,PD-L1抑制剂)
很多人想了解针对一代靶向药物耐药后,采用靶向联合免疫方案,是不是会增强疗效?但结果是——疗效没有明显增强,严重副作用却增加。
在Ⅰ期TATTON研究的初步结果显示,奥希替尼联合 durvalumab,治疗EGFR T790M突变的非小细胞肺癌患者中获得肿瘤整体缓解率(ORR)为57% 。但是患者出现间质性肺病的发生率比两个药单独使用上升数倍,这个联用方案随机弃用,连3期临床试验也被停止。
b. 单药Durvalumab
2018年3月,《柳叶刀肿瘤(The Lancet Oncology)》杂志在线发表了ATLANTIC研究(NCT02087423)结果,这是Durvalumab单药作为非小细胞肺癌3线及以上疗法的一个临床试验。
这个研究中比较特别的是,有一部分EGFR或ALK基因突变阳性的患者,他们都是在接受化疗及至少1种靶向药物治疗后进展的。
结果显示采用单药Durvalumab(10mg/kg,每2周1次)治疗,肿瘤细胞不同PD-L1表达水平下,患者的缓解率不同。
28名PD-L1表达比例不足25%的患者中,肿瘤整体缓解率(ORR)为3.6%,1名患者部分缓解。但是74名PD-L1表达比例≥25%,缓解率(ORR)达12.2%,治疗6个月后疾病控制率为20.3%。
不过这个临床试验中,并没有明确说这些EGFR阳性突变的患者中,有没有接受过奥希替尼治疗的患者。这个试验仅仅只能一个参考,或许可能,如果患者在奥希替尼耐药之后,检查肿瘤细胞PD-L1高表达性耐药,免疫治疗或许是一种选择。
多靶点的靶向药物可以针对很多靶点进行抑制,并且无需进行基因检测。
就在本月,国家食品药品监督管理总局(CFDA)正式批准盐酸安罗替尼(福可维)用于晚期非小细胞肺癌(NSCLC)患者的三线治疗。这是目前国内外首个用于肺癌治疗的口服多靶点靶向药物。
盐酸安罗替尼(AL3818,Anlotinib,商品名:福可维,FOCUS V)是一种新型小分子多靶点酪氨酸激酶抑制剂,能有效抑制VEGFR、PDGFR、FGFR、c-Kit等激酶,具有抗肿瘤血管生成和抑制肿瘤生长的作用。
还是今年即将召开的(ASCO)年会,国内团队将公布ALTER 0303研究结果中,安罗替尼对比的安慰剂对照。总生存期延长3.33个月,无进展生存期延长3.97个月,肿瘤缓解率和控制率均有显著提高。
这个临床试验中,有一部分患者是EGFR突变阳性患者(93名分入安罗替尼组,45名分入安慰剂对照组),其中有10名患者接受过奥希替尼治疗耐药,7名接受安罗替尼治疗,3名患者接受安慰剂对照治疗,结果显示安罗替尼治疗患者的中位无进展生存期有延长(4.0个月 vs 0.40个月,P= 0.0076, HR = 0.108),中位生存期(OS)也明显延长(10.1个月vs 2.20个月,P= 0.03, HR = 0.071) 。
需要指出的是,以上很多探索都是奥希替尼作为T790M耐药突变后的探索。随着今年美国奥希替尼在非小细胞肺癌一线治疗方案的获批, 由于可能耐药机制不同,耐药之后的治疗探索更是需要更多的研究和尝试。
登山路上,有时我们以为山穷水尽时,也可能是豁然开朗。
是继续与之攀登,至死方休?
还是与自己和解,体面结束旅行?
结果没有对错,选择本身已是成功。
为让大家更加清楚EGFR突变用药的完整历程,我们也专门制作了一个大型树状图,有需要可复制链接到浏览器查看:
http://naotu.baidu.com/file/d2c0ed638da9c217bb49885ed5adef1a?token=f6d1689a8a861554
 树状图部分截取
树状图部分截取
参考资料:
1. Garassino Marina Chiara,Cho Byoung-Chul,Kim Joo-Hang et al. Durvalumab as third-line or later treatment for advanced non-small-cell lung cancer (ATLANTIC): an open-label, single-arm, phase 2 study.[J] .Lancet Oncol., 2018, 19(4): 521-536.
2. Z.-H. Tang, J.-J. Lu, Osimertinib resistance in non-small cell lung cancer: Mechanisms and therapeutic strategies, Cancer Letters (2018), doi: 10.1016/j.canlet.2018.02.004.
3. Arulananda S, Do H, Musafer A, Mitchell P, Dobrovic A, John T. Combination Osimertinib and Gefitinib in C797S and T790M EGFR-Mutated Non-Small Cell Lung Cancer. J Thorac Oncol. 2017 Nov;12(11):1728-1732. doi: 10.1016/j.jtho.2017.08.006.
4. Y. Jia, C.H. Yun, E. Park, D. Ercan, M. Manuia, J. Juarez, et al., Overcoming EGFR (T790M)
and EGFR (C797S) resistance with mutant-selective allosteric inhibitors, Nature 534 (2016)
129-132.
5. L. Li, H. Wang, C. Li, Z. Wang, P. Zhang, X. Yan, Transformation to small-cell carcinoma as
an acquired resistance mechanism to AZD9291: A case report, Oncotarget 8 (2017) 18609-18614.
5. J.S. Ham, S. Kim, H.K. Kim, S. Byeon, J.M. Sun, S.H. Lee, et al., Two cases of small cell lung cancer transformation from EGFR mutant adenocarcinoma during AZD9291 treatment, J Thorac Oncol 11 (2016) e1-e4.
6. M.G. Oser, M.J. Niederst, L.V. Sequist, J.A. Engelman, Transformation from non-small-cell lung cancer to small-cell lung cancer: molecular drivers and cells of origin, Lancet Oncol 16 (2015) e165-e172.
7. S. La Monica, D. Cretella, M. Bonelli, C. Fumarola, A. Cavazzoni, G. Digiacomo, et al., Trastuzumab emtansine delays and overcomes resistance to the third-generation EGFR-TKI osimertinib in NSCLC EGFR mutated cell lines, J Exp Clin Cancer Res 36 (2017) 174.
8. K. Uchibori, N. Inase, M. Araki, M. Kamada, S. Sato, Y. Okuno, et al., Brigatinib combined
with anti-EGFR antibody overcomes osimertinib resistance in EGFR-mutated non-small-cell lung cancer, Nat Commun 8 (2017) ncomms14768.
9. Yang J-J, Fang J, Shu Y, et al. A phase Ib trial of savolitinib plus gefitinib for Chinese patients with EGFR-mutant MET-amplified advanced NSCLC. Presented at: International Association for the Study of Lung 10. Cancer 18th World Conference on Lung Cancer; October 2017; Yokohama, Japan. Abstract 8995.
York ER, Varella-Garcia M, Bang TJ, Aisner DL, Camidge DR. Tolerable and Effective Combination of Full-Dose Crizotinib and Osimertinib Targeting MET Amplification Sequentially Emerging after T790M Positivity in EGFR-Mutant Non-Small Cell Lung Cancer. J Thorac Oncol. 2017 Jul;12(7):e85-e88.
11. S.I. Ou, N. Agarwal, S.M. Ali, High MET amplification level as a resistance mechanism to osimertinib (AZD9291) in a patient that symptomatically responded to crizotinib treatment post-osimertinib progression, Lung Cancer 98 (2016) 59-61.
12. Martinez-Marti A, Felip E, Matito J, et al. Dual MET and ERBB inhibition overcomes intratumor plasticity in osimertinib-resistant-advanced non-small-cell lung cancer (NSCLC). Ann Oncol. 2017 Oct 1;28(10):2451-2457.
13. J Xu, JH Wang, SC Zhang. Mechanisms of resistance to irreversible epidermal growth factor receptor tyrosine kinase inhibitors and therapeutic strategies in non-small cell lung cancer. Oncotarget. 2017; 8:90557-90578.
14. Ho CC, Liao WY, Lin CA, Shih JY, Yu CJ, Chih-Hsin Yang J. Acquired BRAF V600E Mutation as Resistant Mechanism after Treatment with Osimertinib. J Thorac Oncol. 2017; 12:56-72. https://doi.org/10.1016/j.jtho.2016.11.2231.
15. Ham Jun Soo,Kim Seokhwi,Kim Hee Kyung, et al. Two Cases of Small Cell Lung Cancer Transformation from EGFR Mutant Adenocarcinoma During AZD9291 Treatment.[J] .J Thorac Oncol, 2016, 11(1): e1-4.
16. Marcoux N, Gettinger SN, O’Kane GM, et al. Outcomes of EGFR-mutant lung adenocarcinomas (AC) that transform to small cell lung cancer (SCLC). J Clin Oncol 36, 2018 (suppl; abstr 8573).
17. Nie KK, Zhang ZF, Zhang CL, et al. Effect of EGFR C797S/G mutation on osimertinib resistance in Chinese patients with non-small-cell lung cancer. J Clin Oncol 36, 2018 (suppl; abstr e21171).
18. Li K, Han BH, Wang QM, et al . OS outcomes to anlotinib in patients (pts) with refractory NSCLC of both wild-type (WT) and mutant EGFR. J Clin Oncol 36, 2018 (suppl; abstr e21013).
本文仅供医学药学专业人士阅读







.jpg-pd13)

.jpg-pd13)








 X
X