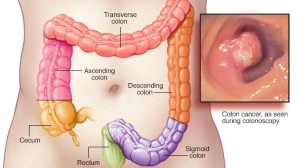
2021年第15届国际肝癌协会(ILCA)年会昨日顺利落下帷幕。会议由国际肝癌协会(ILCA)主办,是肝癌相关学科领域临床、基础研究、转化研究及相关专业人士的重要会议,以分享最佳实践和发现,推动肝癌发病机制、预防和治疗方面的研究。今天,我们就来好好梳理一下在本次会议中,都有哪些值得关注的肝胆大事件!
肝 癌 篇
1.D+T+局部治疗开启
肝癌联合治疗新方向
检查点抑制剂在HCC中的疗效令人鼓舞,单药PD-1/PD-L1抑制剂通过消融过程增强免疫反应提高了疗效。然而,联合使用双免疫检查点抑制剂度伐利尤单抗+tremelimumab+TACE/RFA的影响尚未得到评估。
在这项初步研究中,研究人员招募了30名晚期、拒绝或不耐受索拉非尼的晚期或不可切除HCC患者。Tremelimumab在第1天静脉(IV)给予75 mg,每4周一次,共4次剂量;度伐利尤单抗在第1天静脉给予1500 mg,每4周一次,直到病情进展。第36天给予TACE或RFA治疗。主要终点为6个月无进展生存率(PFS);次要终点为安全性。
30%的患者之前接受过索拉非尼治疗,57%的患者存在局部晚期疾病。9例患者接受免疫联合治疗,21例患者接受联合RFA/TACE治疗。研究结果显示,在接受消融治疗(意向治疗)联合免疫治疗组和单独免疫治疗组中,中位OS和PFS分别为13.6个月和19.2个月,4.9个月和4.4个月。与接受RFA的患者相比,接受TACE的患者中位PFS为7.4个月 vs 4.3个月,中位OS为20.5个月 vs 16.5个月。在安全性方面,3/4级不良事件表现为淋巴减少(43%)、天冬氨酸转氨酶增加(43%)、淀粉酶增加(33%)和贫血(30%)。

因此,可以看出,加入消融治疗可以改善患者的预后,并且联合治疗对于那些无法接受抗血管生成治疗的HCC患者是一种治疗选择。需要进一步的研究来确定哪些患者对这一方案最有可能作出反应。
2.阿替利珠单抗+贝伐珠单抗
改善白蛋白-胆红素1级HCC患者的OS
基于 IMbrave150(NCT034379)研究,阿替利珠单抗+贝伐珠单抗(A+T)已在超过 70 个国家被批准用于无法切除HCC患者的一线治疗。此次大会进一步报道了基线时 ALBI 分级对肝功能结果的影响。
中位随访15.6个月时,在ALBI级1级HCC患者中,“T+A”组vs 索拉非尼组患者的中位OS分别为NE vs 15.4个月 (HR, 0.50;95% CI,0.35-0.72)。在ALBI 2级患者中,中位OS分别为11.7个月和12.2个月(HR, 0.92;95%CI,0.66-1.29)。对ALBI 2级疾病患者的进一步分型显示,在改良ALBI (mALBI)分级为 2a级HCC患者中,“T+A”的中位OS为14.1个月,而索拉非尼的中位OS为12.4个月;mALBI 2b级HCC患者中位OS分别为10.5个月和10.4个月。
进一步的分析结果显示,ALBI级1级和2级疾病患者的中位无进展生存期分别为5.6个月和4.2个月。根据mALBI分级,“T+A”治疗2a级疾病的患者中位PFS为5.6个月,而索拉非尼治疗的患者中位PFS为4.7个月;mALBI 2b级疾病患者的中位无进展生存期分别为6.5个月和4.2个月。
“T+A”组的确诊总缓解率(ORRs)在mALBI 1级HCC患者中为32%,在mALBI 2a级HCC患者中为30%,在mALBI 2b级疾病患者中为25%。索拉非尼组的ORR分别为6%、11和23%。在“T+A”组中,10%的mALBI 1级疾病应答者、6%的mALBI 2a级疾病应答者和4%的mALBI 2b级疾病应答者中观察到完全缓解(CRs)。1例mALBI 2b级疾病患者用索拉非尼获得CR。
3.CheckMate 040研究5年随访数据
公布,O药二线治疗安全有效
索拉非尼初治和索拉非尼经治的晚期肝细胞癌(aHCC)患者死亡率高、预后更差。CheckMate 040 (NCT01658878)队列1和队列2的结果显示,纳武利尤单抗(O药)单一疗法对晚期HCC患者具有临床活性。本次大会进一步报告了该研究两个队列5年随访的安全性和有效性。队列1纳入的aHCC患者,以递增剂量水平(0.1–10.0 mg/kg)接受O药单药治疗。队列2纳入的aHCC患者接受 O药单药(3 mg/kg,q2w)治疗。
结果显示:索拉非尼初治组(N = 80)的中位随访 62.9 个月,索拉非尼经治组(N = 154)中位随访62.8个月。初治组ORR为20%,DCR为53%,中位TTR为2.7个月,中位 DOR为22.6 个月。经治组患者中,ORR和DCR分别为14%和56%,中位TTR为2.8个月,中位DOR为39.7个月。
索拉非尼初治和经治组中位OS分别为26.6个月和15.2个月。两组3年和5年OS率分别为27.6% vs19.9%;13.9% vs 12.1%。可以看出,经过5年的随访,无论之前是否接受过索拉非尼治疗,O药均能显示出持久的反应。
4.真实世界研究:瑞戈非尼治疗
不可切除肝癌,与临床研究结果一致
基于RESORCE研究结果,2017年4月FDA批准瑞戈非尼用于既往接受过索拉非尼治疗的HCC患者;2017年12月12日,该适应证在我国获批。与 RESORCE相比,REFINE的患者群体更加多样化,本次大会分析 REFINE(N = 1031)所有患者的情况。
研究纳入了uHCC 患者1031例,1008例可用于分析评估,96%曾接受过索拉非尼治疗,9%曾接受过免疫治疗,55%来自亚洲。基线检查时,大多数患者为BCLC C 期(62%)和 Child-Pugh A 级(62%),患者均使用瑞戈非尼治疗。主要目的是评估治疗紧急不良反应 (TEAE)和剂量调整的发生率。在研究开始时,59%的患者有转移,34%有血管侵犯。中位观察期为8.6个月,91%的患者经历了TEAE,44%的患者经历了导致剂量调整的TEAE。最常见的TEAE是手足皮肤反应(32%)、腹泻(29%)等。中位PFS为3.8个月,中位OS为12.9个月。这一结果与先前期中分析报告的初步数据以及III期RESORCE试验一致,支持瑞戈非尼在广泛uHCC 患者中的实际疗效和安全性。

5.TACE联合阿帕替尼治疗BCLC C期
肝癌的疗效及预后因素
阿帕替尼是我国具有自主知识产权的小分子靶向药物。可抑制肿瘤新生血管,抑制残余肿瘤生长。以往研究表明,阿帕替尼联合TACE可延长晚期肝癌患者的无进展生存期(PFS)和总生存期(OS)。本次大会又探讨 TACE 联合阿帕替尼治疗巴塞罗那临床肝癌 C 期(BCLC C)肝细胞癌(HCC)的疗效及影响预后的因素。
结果显示,联合组的客观缓解率(ORR)、疾病控制率(DCR)、中位进展时间(TTP)和 OS均高于TACE 组,ORR分别为42.10% vs 25.71%,P=0.03;DCR分别为84.21% vs 55.71%,P=0.001;TTP分别为5.5个月vs 3.7个月,P=0.02;OS分别为10.0个月vs 6.2个月,P=0.01。但联合治疗组不良事件更多。单变量和多因素Cox回归分析显示肿瘤大小、Child-Pugh 分级和门静脉癌栓可能是影响患者预后的因素。
6.PETAL 研究:HCC患者TACE后
接受帕博利珠单抗治疗的IB期研究
TACE是肝癌患者常用的治疗手段,免疫治疗是近年来兴起的肿瘤治疗手段。经TACE治疗后HCC患者再行免疫治疗是否可行?一项探索TACE 后接受免疫治疗的 Ib期研究探索了该方案的疗效和安全性。研究纳入32名中期HCC患者,患者先接受最多两轮TACE,一个月后采用帕博利珠单抗(K药),主要研究终点是在剂量限制毒性(DLT)的安全性。
结果显示:在11名患者中,6名患者在1次TACE后接受K药治疗,5名患者在2次TACE后接受K药治疗。联合治疗未报告剂量限制毒性(DLT),无协同毒性。90%的患者出现了可能与治疗相关的不良事件,最常见的是疲劳(45%)和皮疹(45%)。从TACE治疗开始的中位PFS 开始为9.7个月,从K药治疗开始的中位PFS为6.1个月。可以看出,TACE后帕博利珠单抗用药具有可耐受的安全性,没有协同毒性的证据。
7.真实世界数据:既往/同时放疗
增强肝癌患者免疫治疗疗效
临床前研究发现,辐射可以使免疫系统启动,并产生协同抗肿瘤免疫,从而实现持久的疾病控制,但迄今为止发表的临床数据很少。为了研究放疗和PD-1抑制剂联合治疗转移性和复发性肝癌的有效性和安全性,研究人员进行了这项试验。
34例被诊断为IV期或复发性肝癌患者被纳入研究,接受放射治疗后使用PD-1抑制剂或同时使用PD-1抑制剂。共92个病灶(肝脏28个,静脉肿瘤栓28个,淋巴结13个,骨18个,其他5个)接受放疗。辐射剂量从40Gy到60Gy不等(每部分2-5Gy)。分别有17例患者、15例患者、5例患者、1例患者和1例患者接受特瑞普利单抗、信迪利单抗、卡瑞利珠单抗、纳武利尤单抗和帕博利珠单抗治疗。31例患者在使用免疫治疗和放疗期间接受了靶向治疗,其中索拉非尼17例,仑伐替尼10例,瑞戈非尼3例,阿帕替尼1例。
治疗后各有3例、18例、11例患者完全缓解、部分缓解、病情稳定。ORR为61.8%,DCR为94.1%。中位随访时间为16.5个月。中位总生存期(OS)和无进展生存期(PFS)分别为15.4个月和11.3个月。1年OS和PFS分别为62.9%和46.5%。2年OS和PFS分别为31.8%和11.3%。11例(32.3%)患者出现3级不良事件,其中血小板减少6例(4级2例,3级4例),胃肠道事件2例,其他3例。没有出现5级不良反应。
8.TCR-T细胞疗法治疗HCC
数据再更新,临床结果积极
在2020年国际肝病大会(ILC)上,已经公布了基于T细胞的首款肝癌新型TCR-T疗法ADP-A2AFP的研究结果,显示1例患者CR,所有患者AFP水平均下降!在本次会议上,再度公布了该研究第三队列患者的最新数据。

TCR-T细胞疗法ADP-A2AFP靶向的是在肝癌细胞中过度表达的甲胎蛋白。截至今年4月5日, I期临床试验的队列3中13名晚期肝细胞癌患者接受了ADP-A2AFP的治疗。
结果显示,两名患者报告了总共3种与治疗相关的严重 AE,包括细胞因子释放综合征(1 级)、输液相关反应(2 级)和中性粒细胞减少症(3 级)。最佳总体反应包括1例完全缓解(CR)、4例疾病稳定(SD)、4例疾病进展(PD),1例在数据截止时没有扫描结果。疾病控制率为64%。从第16周到第32周,队列3中完全缓解患者的靶病灶 (TL) 病灶直径 (SLD) 总和降低了100%。
在两名以上患者中出现的不良事件(AE)包括中性粒细胞减少症、白细胞减少症、淋巴细胞减少症、发热、贫血、细胞因子释放综合征、发热性中性粒细胞减少症、血小板减少症、天冬氨酸转氨酶升高、丙氨酸转氨酶升高。ADP-A2AFP表现出可接受的安全性特征,没有报告出现显著T细胞相关肝脏毒性和限制剂量的毒性。基于这些数据支持继续研究。
肝内胆管癌篇
Y-90内放射治疗(SIRT)联合化疗
创一线治疗OS近2年
在今年,基于回顾性LEGACY试验的结果,美国FDA批准TheraSphere Y-90用于肝癌患者的治疗。这是全球首款放射性玻璃微球,专门针对肝癌治疗,为晚期肝癌患者开辟了创新的“内放射治疗”。
此前,在一项II期临床研究(MISPHEC试验)中,Y-90微球也开始用于胆管癌。研究共纳入41例未接受化疗或动脉内治疗、无法手术的肝内胆管癌患者,接受SIRT联合GP化疗治疗。中位随访36个月,中位PFS为14个月,中位OS为22个月。1年和2年OS率分别为75%和45%;1年和2年无进展生存率分别为55%和30%。
在2021年ILCA会议上报告的单臂研究结果中,24例肝内胆管癌患者被分配到1个疗程的SIRT-Y90,通过肝动脉给予肝内肿瘤至少120 Gy的剂量。患者随后在每3周的第1天和第8天接受最多8个周期的化疗,顺铂的剂量为25 mg/m2,吉西他滨的剂量为1000 mg/m2。主要终点是OS。次要终点包括PFS、客观缓解率(ORR)、疾病控制率(DCR)、毒性。
在16例SIRT-Y90后接受至少1个周期化疗的患者中,DCR为75%,ORR为25%,mPFS和mOS分别为9.0个月和21.6个月。在意向治疗(ITT)人群中,使用SIRT-Y90后,ORR为16.7%,DCR为58.3%。在8例无法接受后续化疗的患者中,12.5%的患者病情进展。
在ITT人群中3/4级毒性的发生率小于10%。在SIRT部分,最常见的3/4级毒性包括腹痛(4%)、呕吐(4%)、腹水(4%)、天冬氨酸转氨酶(AST)升高(4%)、血胆红素升高(4%)和高钙血症(4%)。目前的研究表明,ICC采用Y90配合标准GP化疗的方法是可行有效的,对于选择ICC患者进行这种联合治疗的进一步分析是必要的。
本文仅供医学药学专业人士阅读





.jpg-pd13)
.jpg-pd13)









 X
X